|
||||
|
|
ГЛАВА 8 Бесплодие самцов Л. Кинан (Laurence R. J. Keenan) ВВЕДЕНИЕ Диагноз «бесплодие» ставят кобелю после нескольких неудачных попыток оплодотворить одну или нескольких фертильных сук в наиболее благоприятный для вязки период эструса. Типы бесплодия могут различаться по тяжести и длительности. В случае полного и перманентного бесплодия кобеля считают стерильным. Однако бесплодие может быть неполным, частичным или временным, при этом кобель демонстрирует ограниченную фертильность, характеризующуюся низкой способностью к оплодотворению и/или малочисленностью помета. Несмотря на всю очевидность данной патологии, установить вызвавшие ее причины, провести диагностику и лечение отнюдь не просто. Бесплодных самцов можно разделить на две категории: • самцы, не способные к совершению нормального коитуса; • самцы, не способные к оплодотворению. НЕСПОСОБНОСТЬ К НОРМАЛЬНОЙ ВЯЗКЕ У КОБЕЛЕЙ Самцы не могут совершить вязку из-за снижения либидо и/или наличия физических отклонений. Последние обусловливают отсутствие интереса или неприятные ощущения во время коитуса, препятствующие его проведению. Отсутствие либидоДанное нарушение определяют как отказ от совершения коитуса, представляющего собой совокупность определенных поведенческих, физиологических и психологических процессов, включающих сексуальный интерес, возбуждение, эрекцию, интромиссию и эякуляцию. Клинические признаки сниженного либидо варьируют от полного отсутствия сексуального интереса и неспособности к коитусу до задержки демонстрации либидо или наступления эрекции и выраженного снижения интереса к коитусу. Дефект может быть врожденным и проявляться уже при первой вязке, или приобретенным — и наблюдаться у кобелей, ранее использовавшихся в качестве производителей. Как правило, в последнем случае патология развивается постепенно, отсутствие либидо обусловливается разрушением клеток Лейдига под воздействием внешних агентов. Сексуальность во многом определяется наследственными факторами, однако и окружение играет важную роль в изменении полового поведения, поэтому установить, насколько часто в основе патологии лежат генетические отклонения, довольно сложно. Редкие врожденные патологии (например, гипофизарный нанизм), проявляющиеся в нарушении связи между гипоталамусом, гипофизом и половыми железами, влияют на концентрацию тестостерона и соответственно на либидо. Однако во многих случаях низкое либидо у собак связано не с генетическими нарушениями, а с влиянием окружающей среды. Хотя для снижения либидо кобелю с сильной половой потенцией требуется более интенсивное негативное воздействие (травма или другой отрицательный опыт) по сравнению с самцом, имеющим более слабую потенцию. Среди факторов, влияющих на формирование патологии, можно выделить следующие: • Ошибки в племенной работе, такие, как некорректный выбор сроков вязки; чрезмерное использование производителя; ограничение общения с суками, приводящее к формированию робости; проведение первой вязки с неопытной и, возможно, агрессивной сукой; «коррекция» полового поведения на период участия в испытаниях и выставках; проведение вязки в неподходящем или незнакомом месте; • Стресс (травмы или другой отрицательный опыт) во время предыдущей вязки; • Связанные с возрастом проблемы: у молодых кобелей либидо часто снижено из-за задержки полового созревания и соответственно низкого уровня тестостерона. Сходная картина может наблюдаться у старых собак из-за одряхления, переутомления или наличия каких-либо болезней; • Системные заболевания, сопровождающиеся повышением температуры, анорексией и общим ослаблением организма, а также связанные с нарушениями синтеза кортикостероидов или гипотиреозом; • Использование лекарственных средств: многие из них снижают концентрацию тестостерона и, следовательно, негативно влияют на либидо, в их числе глюкокортикоиды, эстрогены, прогестагены, анаболические стероиды, циметидин и кетоконазол. Следует учитывать, что злоупотребление препаратами тестостерона, назначаемыми для повышения либидо, приводит к подавлению секреции ЛГ, а, значит, и к уменьшению выработки эндогенного тестостерона. Данный эффект обусловлен работой механизма отрицательной обратной связи с гипофизом; • Плохое питание: недостаточность рациона иногда обусловливает задержку полового созревания кобелей, ожирение вызывает общую вялость и провоцирует другие заболевания, влияющие на сексуальную активность, например, артриты. Физические дефектыМогут наблюдаться как у кобеля, так и у суки и в зависимости от причины оказывать различное воздействие на репродуктивные способности. После соответствующей коррекции, если она возможна, фертильность полностью восстанавливается. Животные, страдающие хроническими заболеваниями, могут испытывать болезненные ощущения при попытке совершения коитуса. В подобном случае прогноз неблагоприятный. Отдельные физические недостатки: Затруднения при совершении садкиСреди причин затруднений при проведении садки выделяют некоторые патологии предстательной железы, а также болезненность, в том числе при ортопедических заболеваниях позвоночника, тазобедренных или коленных суставов. Невозможность совершения интромиссииВрожденные дефекты пениса и препуция — сохранение уздечки полового члена, гипоплазия пениса или стеноз препуциального отверстия — препятствуют нормальному совершению коитуса. Структурные дефекты, характерные для некоторых пород (например, английского бульдога), делают коитус невозможным. Приобретенные дефекты — травмы, разрывы и опухоли пениса и/или препуция — затрудняют интромиссию или делают ее невозможной в связи с болезненностью или невозможностью выдвинуть пенис. Преждевременное достижение полной эрекции может наблюдаться у молодых кобелей при перевозбуждении. В норме кровенаполнение луковицы головки полового члена происходит после введения пениса в вагину; если же оно происходит раньше, интромиссия невозможна. Сохранение или утолщение гимена, наличие отклонений в конфигурации таза самки («направление влагалища вверх») также затрудняют интромиссию. Невозможность достижения нормального замка может быть обусловлена констрикцией полового тракта самки из-за излишнего напряжения во время вязки, которое возникает на фоне фригидности или наличия физических дефектов, однако чаще происходит при некорректном выборе сроков вязки. НЕСПОСОБНОСТЬ К ОПЛОДОТВОРЕНИЮ У КОБЕЛЕЙ Кобели, не способные к оплодотворению, могут иметь нормальное либидо и не испытывать затруднений при вязке. Бесплодие или снижение фертильности обусловлены следующими факторами: • Неполная эякуляция или ее отсутствие; • Снижение качества и количества сперматозоидов или их отсутствие; • Патологические изменения семенной жидкости. Неполная эякуляция или ее отсутствиеНаблюдается при неполном замке. Неполная эякуляция либо ее отсутствие может объясняться страхом или дискомфортом во время коитуса или сбора семени, а также расстройствами симпатической нервной системы или ослаблением внутреннего сфинктера уретры. Снижение качества и количества сперматозоидов или их отсутствиеПри анализе спермы самцов, страдающих указанным нарушением, выявляют одно или несколько из перечисленных отклонений: • Азооспермия — отсутствие сперматозоидов в эякуляте при наличии нормальной эякуляции; • Олигозооспермия — снижение количества сперматозоидов в эякуляте; • Астенозооспермия — высокое процентное содержание малоподвижных сперматозоидов в эякуляте; • Тератозооспермия — высокое процентное содержание сперматозоидов с морфологическими дефектами в эякуляте. Перечисленные нарушения бывают как врожденными, так и приобретенными. Врожденные дефекты зачастую обусловлены заболеваниями половых желез (такими, как гипоплазия тестикулов) или возникают в результате аномалий развития репродуктивной системы. Гипоплазия тестикулов — наследственная или врожденная патология, причиной которой являются отсутствие или значительное снижение количества сперматогониев в семенниках. Следует иметь в виду, что плохое качество спермы может быть связано с препубертатным возрастом, поэтому диагноз «тестикулярная гипоплазия» ставят после того, как животное достигнет половой зрелости. Поражение чаше всего бывает двусторонним. Из-за снижения количества семенных канальцев тестикулы у таких животных существенно меньше обычных для данной породы. Функционирование клеток Лейдига и либидо соответствуют норме. Образцы спермы зачастую отличаются водянистой консистенцией и прозрачностью в связи с отсутствием сперматозоидов или значительным снижением их количества. В более легких случаях самец частично сохраняет фертильность, однако из-за наследственного характера патологии таких животных не используют в племенной работе. Нарушения сперматогенеза могут иметь генетическое происхождение. Патология проявляется в недостаточной подвижности (синдром Картагенера) или специфических дефектах сперматозоидов (двойной хвост, спиралевидный хвост, двойная головка). Вероятной причиной отклонений могут быть также хромосомные нарушения: синдром XXY, проявляющийся в недоразвитии и размягчении тестикулов и полном отсутствии сперматогенеза у фенотипических самцов; синдром XX, вызывающий полную стерильность (описан у нескольких пород, таких, как кокер-спаниели, керри-блю-терьеры, веймаранеры и короткошерстные немецкие пойнтеры). У кобелей с указанным дефектом тестикулы могут не опуститься в мошонку и иногда встречаются пороки развития пениса. Врожденные двусторонние аномалии эпидидимисов и семявыводящих протоков приводят к азооспермии и, возможно, к развитию гранулемы и сперматоцеле. Олигозооспермия и нарушение фертильности наблюдаются у самцов с односторонним крипторхизмом или односторонней сегментальной аплазией семявыводящей системы. Приобретенные дефекты связаны с дегенерацией или атрофией тестикулов. Заболевания в зависимости от их причины, длительности и тяжести приводят к полному или частичному прекращению сперматогенеза или развитию неполноценных сперматозоидов. Как правило, кобели, страдающие бесплодием в связи с приобретенными дефектами репродуктивного тракта, до болезни имели нормальную фертильность. Именно перенесенные заболевания репродуктивной системы повлекли за собой изменения параметров спермы, ставшие причиной снижения или утраты способности к оплодотворению. Болезни, вызывающие подобные последствия, протекают обычно в острой форме, но могут развиваться и постепенно. При тяжелых поражениях наблюдается азооспермия или высокое процентное содержание малоподвижных или дефектных спермиев (с дефектами головки, тела и хвоста сперматозоида). В некоторых случаях после устранения половой дисфункции сперматогенез со временем восстанавливается. К сожалению, гораздо чаще подобные патологии прогрессируют и переходят в хроническую форму, приводя к полной стерильности. Многие из указанных заболеваний сопровождаются характерными симптомами или вызывают изменение общего состояния (орхит), хотя гораздо чаще клинические проявления ограничиваются лишь изменением тестикулов и снижением репродуктивной способности. При длительном хроническом течении болезней семенники становятся размягченными и дряблыми, а у старых кобелей — уплотненными и сморщенными из-за ухудшений, связанных с возрастом. Инфекции или травмы обычно сопровождаются отеком и болезненностью. Неопластические изменения вызывают увеличение пораженного семенника, как правило, одностороннее, хотя в противоположном семеннике могут отмечаться некоторые признаки дегенерации. Факторы, обусловливающие приобретенное бесплодие: • Инфекции семенников, вызывающие орхит и/или эпидидимит и заканчивающиеся азооспермией. Тяжелые воспаления, приводящие к обтурации семявыводящей системы. Местные повреждения, связанные с инфекциями, способными разрушать гемато-тестикулярный барьер, в результате иммунная система вырабатывает специфические антитела, разрушающие спермии. Иммуно-опосредованные заболевания, приводящие к фиброзам, спермальной гранулеме и обструкции семявыводящих протоков. Неспецифические бактерии, Brucella canis и генитальные микоплазмы. Любое повышение температуры в области тестикулов, оказывающее пагубное воздействие на сперматогенез, причем тяжесть поражения зависит от длительности нарушения. Общее повышение температуры, дерматит мошонки, орхит и, возможно, значительное повышение температуры окружающей среды; • Травмы, укусы, ушибы, вызывающие местное повышение температуры тестикулов или способствующие разрушению гемато-тестикулярного барьера, приводящему к иммунным заболеваниям; • Лекарственные средства и токсины, способные напрямую поражать сперматогенный эпителий и тем самым влиять на сперматогенез. Противоопухолевые препараты (циклофосфамид, хлорамбуцил, циспластин). Радиация, источником которой является окружающая среда. Диагностические или терапевтические мероприятия. Препараты (андрогены, анаболические стероиды, глюкокортикоиды), которые косвенно влияют на сперматогенез, воздействуя на связь гипоталамуса с половыми железами; • Опухоли тестикулов, понижающие продукцию спермы, которые прорастают и сдавливают здоровую ткань семенников, а также за счет выработки стероидов, которые подавляют гипоталамо-гипофизарную активность по отрицательной обратной связи и вызывают последующий асперматогенез. Отклонения в составе плазмы спермыВ некоторых случаях (таких, как травмы, заболевания или инфекции пениса, препуция, уретры или добавочных желез) в семенной жидкости обнаруживаются примеси, поступающие из других систем организма, не связанных с репродуктивным трактом. Влияние изолированных нарушений состава семенной жидкости на фертильность неизвестно. Сперму исследуют с целью выявления отклонений, таких, как: Снижение общего объемаОбъем секрета простаты может снижаться в связи с ее хронической гиперплазией. Однако, как и у других животных, объем семенной жидкости непосредственно на фертильность не влияет. Изменение цветаЖелтый или зеленый оттенки семенной жидкости указывают на то, что в ней присутствует некоторое количество мочи или воспалительного экссудата. Коричневый оттенок, свидетельствующий о наличии гемолизированной крови, наблюдается при заболеваниях предстательной железы. Красный оттенок обусловлен примесью свежей крови, попавшей в семенную жидкость в результате травмы пениса, полученной в процессе эякуляции или сбора семени. Кроме того, заболевания предстательной железы могут быть причиной присутствия крови. Как моча, так и кровь оказывают разрушающее воздействие на сперматозоиды, что отражается на фертильности. Повышенное содержание лейкоцитовСодержание лейкоцитов, превышающее 2000/мл, указывает на наличие инфекции (см. ниже). ИнфекцииО присутствии микроорганизмов и о степени их воздействия на животное судят в первую очередь по имеющимся клиническим симптомам. Инфекции распространяются из мочевых путей, придатка семенника, семенных протоков и простаты. Способность бактериальных инфекций вызывать бесплодие представляется спорной, хотя в принципе они могут вызывать олигозооспермию, тератозооспермию, астенозооспермию, а также продуцировать специфические антитела, разрушающие спермин. В уретре и препуции большинства здоровых собак присутствует условно-патогенная микрофлора (Pasteurella, Streptococcus, Staphilococcus, Escherichia coli, Mycoplasma, Ureaplasma), способная вызывать неспецифические инфекции периферических отделов репродуктивного тракта. Увеличение количества анаэробных бактерий указывает на наличие инфекции, тогда как присутствие грамположительных бактерий, вероятно, свидетельствует о дистальной уретральной контаминации. Как правило, присутствие более 10000 бактерий на миллилитр эякулята, особенно при наличии клинических проявлений, указывает на заболевание мочевой или репродуктивной системы. Выявить локализацию инфекции достаточно трудно. Признак ее наличия — высокое содержание лейкоцитов в семенной жидкости, особенно в простатической части эякулята, в сочетании с отсутствием роста бактерий в культуре мочи, полученной центезом. Принимая во внимание вероятность перекрестной инфекции, осложняющей диагностику, основное внимание следует уделять симптомам. Для бактериального простатита характерны две формы: острая и хроническая. Данное заболевание следует отличать от доброкачественной гиперплазии предстательной железы, кист и абсцессов простаты. Острая форма бактериального простатита, как правило, не сопровождается бесплодием. Симптомы — лихорадка, анорексия и угнетенное состояние, а также болезненность при ректальной пальпации. Диагноз ставят на основании данных, полученных с помощью клинических, лабораторных и ультразвуковых исследований. В отсутствие обострений хронический бактериальный простатит протекает бессимптомно. У кобеля отмечаются тенезмы, запоры, гематурия или рецидивирующие инфекции мочевых путей. Диагноз ставят, основываясь на анамнезе, симптомах, цитологическом и бактериологическом исследовании секрета предстательной железы. Следует дифференцировать простатит от инфекций мочевыводящей системы. ПРИЧИНЫ БЕСПЛОДИЯ У КОБЕЛЕЙ При исследовании причин бесплодия у кобелей клиницист может столкнуться с рядом проблем. Неадекватный или недостаточно тщательный подход приводят к необоснованному выбору гормональной терапии, что часто усугубляет ситуацию. Учитывая тот факт, что масштаб исследований определяется затратами на диагностические мероприятия и доступностью необходимого оборудования, клиницист обязан придерживаться строгой логической схемы, предусматривающей сбор анамнеза и полное обследование репродуктивного тракта. Сбор анамнезаТолько исчерпывающие сведения о предыдущих и текущих болезнях, о состоянии репродуктивного тракта позволяют клиницисту определить серьезность проблемы. Информация должна включать в себя сведения об участии в племенной работе и общем состоянии здоровья животного. Ниже приведен приблизительный перечень вопросов. • Сколько сук было повязано данным кобелем? Количество сук должно быть достаточно большим, иначе бесплодие суки может быть ошибочно принято за бесплодие кобеля. • В течение какого периода времени имели место перечисленные вязки? Когда состоялась последняя успешная вязка? • Сколько повязанных сук забеременело? Сколько щенков было в пометах? Не обнаружено ли у щенков врожденных дефектов? • Диагностирована ли беременность у неощенившихся сук? • Имелись ли проблемы в ходе вязки и в течение беременности у повязанных сук? • Как определялись сроки предыдущей вязки? По поведению суки; на основании данных ветеринарного осмотра, проведенного в соответствии с клиническим протоколом; эмпирически, на основании субъективных наблюдений заводчика и/или владельца? • Не страдают ли бесплодием суки, не забеременевшие в результате вязок? Нет ли у них заболеваний репродуктивной системы (например, кистозной гиперплазии эндометрия), вызвавших бесплодие к моменту вязки? • Наблюдались ли изменения в половом поведении и либидо? Если да, проводилось ли лечение данной патологии с применением лекарственных препаратов? • Какие болезни, несчастные случаи и травмы, особенно репродуктивного тракта кобель перенес? Чем он страдает в настоящее время? Клиническое обследованиеДля исключения системных заболеваний, прямо или косвенно отражающихся на репродуктивной способности, необходимо провести полный осмотр животного, уделяя особое внимание обследованию репродуктивного тракта. Некоторые из перечисленных мероприятий помогают прояснить картину при подозрении на бесплодие. Предполагаемые затраты и доступность необходимого оборудования часто определяют масштабы исследования, однако в идеале следует придерживаться рекомендуемого протокола. Осмотр и пальпация наружных половых органовПри осмотре мошонки следует убедиться в наличии в ней семенников, выявить признаки недавних или текущих заболеваний, дерматита или адгезии с семенниками. Тестикулы, в норме свободно перемещающиеся в полости мошонки, исследуют для определения величины, симметричности и консистенции. Они должны быть одинаковыми по размеру и соответствовать параметрам породы. Нормальные семенники должны быть упругими. Уменьшение размеров, уплотнение или, наоборот, размягчение, дряблость семенников свидетельствуют о наличии гипоплазии или дегенерации. Увеличение тестикулов либо наличие узелков указывает на воспалительный процесс или неоплазию. Придаток семенника пальпируют в дорсолатеральной части тестикулов. Отек и узелки — признаки воспаления, гранулематоза или сегментной аплазии, однако отсутствие этих симптомов не исключает патологий эпидидимиса, зачастую протекающих без видимых изменений. Для обследования предстательной железы указательный палец одной руки вводят ректально до обнаружения симметричной двудольной губчатой структуры, пальпируемой впереди лонных костей. Второй рукой нащупывают простату через брюшную стенку и сдвигают ее ректально, надавливая пальцами на брюшную стенку. Пенис и препуций осматривают в последнюю очередь, непосредственно перед процедурой сбора семени, поскольку манипуляция может вызывать эрекцию. При осмотре выявляют наличие травм, инфекций, выделений, неоплазии или врожденных дефектов. Особое внимание следует уделять возможности выдвижения пениса из препуция. Получение спермыПолучение спермы проводят в спокойной обстановке, животное помещают на устойчивую, нескользкую поверхность. Присутствие суки в состоянии охоты облегчает процедуру, но получение спермы возможно и в ее отсутствие, особенно если речь идет об опытном производителе, хотя молодые неопытные кобели или кобели со сниженным либидо могут доставлять некоторые проблемы. Впрочем, иногда и опытные самцы проявляют интерес лишь в присутствии течной суки. Другим, хотя и менее эффективным приемом является стимуляция присутствием суки, обработанной химическим феромоном, — метиловым эфиром п-гидроксибензойной кислоты или вагинальными выделениями течной суки, которые хранились при температуре 2 °C При необходимости препарат размораживают и наносят на вульву имеющейся суки для облегчения сбора семени у кобеля. Кобелю-донору позволяют обнюхать суку, чтобы вызвать у него половое возбуждение. Одновременно оператор производит массаж пениса через препуций, вызывая эрекцию. Перед достижением полной эрекции препуций осторожно сдвигают каудально до луковицы и стимулируют эякуляцию, слегка сдавливая пенис позади луковицы двумя пальцами. В ходе манипуляции следует избегать прикосновений к головке пениса. Эякулят собирают в подготовленную ассистентом подогретую емкость (пластиковую или стеклянную). При использовании другого метода эякулят собирают в стеклянную пробирку, помещенную в латексный конус специальной искусственной вагины, применяемой после выдвижения эрегированного пениса. Емкость для сбора спермы должна быть покрыта изолирующим материалом, сохраняющим тепло. Желательно применять минимум смазки и избегать контакта спермы с латексом. Эякулят состоит из трех фракций. В момент отделения первой фракции, представляющей собой прозрачную жидкость, кобель, как правило, совершает активные толчкообразные движения. При задержке эякуляции самца можно простимулировать осторожным легким прикосновением сосуда для сбора эякулята к крайне чувствительной головке пениса. Вторая фракция имеет мутную консистенцию и содержит наибольшее количество сперматозоидов. После эякуляции второй фракции самец может сделать попытку развернуться, как это происходит во время нормальной вязки. После разворота пениса на 180 градусов в каудальном направлении происходит эякуляция третьей фракции, представляющей собой прозрачный секрет предстательной железы. Обычно ее собирают отдельно для посева на культуру. Начало отделения третьей фракции определяют по отдельным прозрачным каплям эякулята, выделяющимся каждые 1–2 секунды, — это явное свидетельство того, что самец эякулировал все выработанные сперматозоиды. Оценка эякулятаПодвижность сперматозоидов. Пробирку с образцом спермы следует незамедлительно поместить в теплую воду. Каплю материала наносят на подогретое предметное стекло, покрывают другим и немедленно помещают под микроскоп со 100-кратным увеличением для определения поступательного движения сперматозоидов. Если первая и вторая фракция собраны вместе, первая фракция может отрицательно влиять на подвижность сперматозоидов, поэтому сперму разбавляют в соотношении 1:1 0,9 % цитратнымили фосфатным буферным раствором при температуре 37 °C, после разбавления отмечается улучшение подвижности сперматозоидов. Концентрация спермы. Полное исследование предполагает подсчет общего количества сперматозоидов в эякуляте, однако то, что концентрация спермы низкая, обычно становится очевидным уже после первичного исследования. Количество спермиев может варьировать в разных образцах в зависимости от наличия простатической фракции. Многие исследователи часто ограничиваются сбором только второй фракции эякулята, прекращая процедуру перед выделением третьей фракции. По разным причинам, к которым относится и неопытность оператора, первую и вторую фракцию обычно получают вместе, поэтому концентрация спермы напрямую зависит от метода, которым ее собирают. Для оценки фертильности вычисляют общее количество сперматозоидов в эякуляте. Его легко установить, подсчитав число сперматозоидов в капле и пересчитав этот результат на общий объем эякулята. В этом случае получают объективный результат, не зависящий от метода получения спермы. Для более точного определения на практике используют набор для разведения крови 1/100 для подсчета лейкоцитов и гемоцитометр Нейбауера. Берут 20 мкл разведенной спермы (разводят как кровь для подсчета лейкоцитов) и помещают в камеру гемоцитометра. Количество клеток в центральном квадратном миллиметре умножают на 106 и на объем спермы, получают число сперматозоидов в эякуляте. Суточную продукцию спермы определяют, собирая сперму ежедневно в течение 5 дней до стабилизации количества сперматозоидов, т. е. до истощения внегонадного резерва. У здорового фертильного кобеля она составляет примерно 400 х 106 сперматозоидов за 5 дней. Морфология сперматозоидов. Для проведения исследований готовят мазок образца спермы на предметном стекле по аналогии с мазком крови. После высыхания мазок окрашивают в течение 5 минут эозин-нитрозином, анилиновым синим или кристаллическим фиолетовым и изучают под микроскопом при 1000-кратном увеличении в иммерсионной среде. Чтобы дать заключение, подтверждающее наличие или отсутствие морфологических дефектов спермы, необходимо исследовать как минимум 100 сперматозоидов. Лейкоциты. Чтобы определить число лейкоцитов в микролитре, подсчитывают их количество в четырех угловых квадратах гемоцитометра и умножают полученную цифру на 250. При подозрении на инфекцию необходим дифференцированный подсчет лейкоцитов. Посев спермы. Если цитология эякулята дает основания предполагать наличие инфекции, проводят бактериологическое исследование семени и секрета предстательной железы. Объем и рН эякулята. Определяют оба показателя. Определение щелочной фосфатазы в сперме. Щелочная фосфатаза вырабатывается в придатке семенника и присутствует в сперме здорового кобеля. Низкая концентрация или отсутствие фирмента указывает на неполную эякуляцию или двустороннюю обструкцию придатков или семяпровода. Характеристики эякулята здоровых кобелей приведены в табл. 8.1. Незначительные отклонения от нормы не свидетельствуют о бесплодии. Иногда результат, неудовлетворительный по одному параметру, компенсируется превосходными показателями по другому, т. е. кобель со сниженной по сравнению с нормой концентрацией спермы может использоваться в качестве производителя благодаря повышенной подвижности сперматозоидов. В случае первичного бесплодия или неясностей в диагнозе рекомендуется провести повторный анализ спермы. Повторный сбор эякулята следует производить через 2 месяца после первого исследования, поскольку за этот период происходит переход к новому циклу сперматогенеза. Табл. 8.1. Нормальные значения параметров эякулята кобелейЭндокринологический анализ В связи с тем, что секреция многих гормонов носит импульсный характер, к интерпретации единичных анализов следует подходить с осторожностью. Многие заболевания, предполагающие эндокринологическое исследование, неизлечимы, поэтому необходимо принимать во внимание затраты на его проведение. Кроме того, дополнительные расходы могут возникать в связи с обращением в неспециализированные лаборатории, проводящие исследование в порядке исключения. Приведенный ниже протокол поможет выявить источник эндокринной дисфункции. Выработка тестостерона. Наиболее надежный метод оценки продукции тестостерона основан на применении стимуляционного теста с использованием человеческого ХГ (44 МЕ/кг внутримышечно) или ГнРГ (2,0 мкг/кг внутримышечно). Определение концентрации тестостерона проводят перед введением и спустя 4 часа после введения человеческого ХГ или перед введением и через час после введения ГнРГ Нормой считается пост-стимуляционная концентрация тестостерона в пределах 3,7–7,5 нг/мл. Гонадотропины в сыворотке крови. В связи с эпизодическим характером секреции гонадотропинов для определения ЛГ и ФСГ рекомендуется проводить анализ по крайней мере 3 образцов, взятых с интервалом в 20–30 минут. Нормальными показателями считают соответственно 34–85 и 73–84 нг/мл. Интерпретация данных эндокринного анализа. Низкое содержание тестостерона и ЛГ в сыворотке указывает на дисфункцию гипоталамуса, гипофиза или семенников. Устойчиво низкие значения ЛГ после введения ГнРГ (2,0 мкг/кг внутримышечно) позволяют предположить поражение гипоталамуса или гипофиза. Однако повышение уровня ЛГ в результате стимуляции с помощью ГнРГ указывает на нормальное функционирование гипоталамуса/гипофиза, следовательно, источником проблем являются тестикулы. Низкие показатели тестостерона при повышенной концентрации ЛГ указывают на дисфункцию клеток Лейдига. Концентрация ФСГ повышается у животных с дисфункцией семенников, вероятно, из-за нарушения выработки ингибина, обусловленного поражением гонад. Это повышение коррелирует со степенью расстройства сперматогенеза. В отсутствие других изменений низкий уровень ЛГ следует интерпретировать с осторожностью, поскольку такие показатели характерны и для здоровых животных. Кроме того, низкая концентрация ЛГ может являться следствием терапии с назначением стероидов, анестетиков и седативных препаратов. РентгенографияИсследование проводят при подозрении на бесплодие, вызванное заболеванием предстательной железы. Обзорная рентгенограмма каудальной части брюшной полости может выявить увеличение или другие поражения железы. Интерпретация полученных данных применительно к бесплодию зависит от анамнеза и возраста кобеля. Ультразвуковое исследованиеШироко применяется при обследовании предстательной железы и все чаще используется для оценки состояния тестикулов. Простату и тестикулы целесообразно исследовать в продольном и поперечном направлениях, используя сканер 5 МГц или лучше 7,5 МГц в режиме реального времени. Перед обследованием предстательной железы опорожняют кишечник при помощи клизмы. Кисты или абсцессы ясно визуализируются на экране. Наличие уплотненных участков указывает на развитие неоплазии или инфекцию. Ультразвуковое исследование семенников может выявить неоплазию, абсцессы или наличие полостей. Биопсия тестикуловПрименяется для постановки диагноза ценным производителям с персистентной азооспермией или олигозооспермией. Материал получают с помощью инцизионной или пункционной биопсии. Не рекомендуется проводить биопсию здоровым животным, поскольку она может вызывать ухудшение характеристик спермы в связи с воспалительными процессами, спровоцированными процедурой. Инцизионная биопсия. Под общей анестезией через кожу и белочную оболочку семенника, зафиксированного как для кастрации, иссекается небольшой участок ткани. Образец ткани, содержащий семенные канальцы, извлекают с помощью тонкого лезвия. Материал помещают в консервирующий раствор, например, в раствор Буина или в формалиновый, после чего передают на исследование ветеринарному патологу. Пункционная биопсия. Перед процедурой назначают седативные препараты, затем вводят тонкую иглу диагонально в вентральную часть семенника. В принципе процедура может вызвать атрофию тестикулов, но, как правило, этого не происходит. ЛЕЧЕНИЕ БЕСПЛОДИЯ У КОБЕЛЕЙ Бесплодие излечимо, если вызвавшие его заболевания и обстоятельства, такие, как дерматиты мошонки, незначительные физические и психологические стрессы, некоторые препараты и токсины, носили эпизодический характер и не привели к серьезным нарушениям репродуктивного тракта. Выздоровление после перечисленных заболеваний может длиться от 2 до 6 месяцев. Причина такого продолжительного восстановительного периода не только в том, что цикл сперматогенеза занимает около 62 дней, но и в том, что для улучшения низких показателей спермы требуется смена нескольких циклов. Исходя из этих соображений, кобеля-производителя считают здоровым лишь после получения положительных результатов двукратных исследований, проведенных с 2-месячным интервалом. 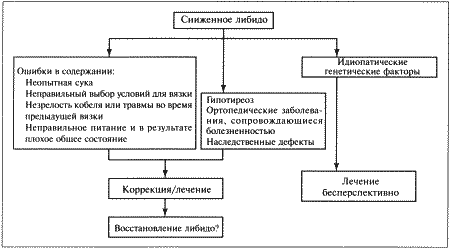 Фиг. 8.1. Фиг. 8.1. Лечение кобелей, демонстрирующих сниженное либидо Низкое либидо и затруднения при вязкеЛечение затруднено и часто безуспешно (фиг. 8.1). Развитию патологии способствуют ошибки в практике проведения вязки и в содержании собаки. Вязки следует проводить с опытной, спокойной сукой и в соответствующей обстановке. Робкого самца можно ободрить, предоставив ему возможность наблюдать за вязкой с участием опытного производителя. Есть вероятность, что терпение, время и вязки со спокойными опытными суками вернут самцу уверенность и сгладят последствия травмирующей ситуации. Правильный диагноз и успешное лечение заболеваний, приводят к восстановлению нормального либидо. Чтобы исключить гипотиреоз, следует проверить функцию щитовидной железы. Если затруднения при вязке связаны с болезненностью суставов, в какой-то мере помогает назначение нестероидных противовоспалительных препаратов. В некоторых случаях для разрешения проблемы достаточно коррекции приобретенных или врожденных дефектов наружных половых органов (фимоза или уздечки). Для поддержания производителя в хорошей физической форме нужно придерживаться легкоусвояемой калорийной диеты. Лечение идиопатических или генетически обусловленных случаев нарушения либидо, как правило, бесперспективно. Противопоказана терапия тестостероном, несмотря на то, что при отсутствии либидо его концентрация обычно снижена. Введение тестостерона приводит к его включению в механизм отрицательной обратной связи с гипофизом, вызывая снижение выработки ЛГ. Помимо этого длительное применение тестостерона оказывает отрицательное воздействие на сперматогенез, ухудшая характеристики спермы. В клинических ситуациях, требующих повышения концентрации тестостерона, автор настоящей главы применял ГнРГ 2,0 мкг/кг внутримышечно или человеческий ХГ 500 ME подкожно дважды в неделю в течение 3 месяцев для стимуляции клеток Лейдига и соответственно выработки эндогенного тестостерона. Однако эта методика недостаточно проверена, и результат лечения неоднозначен. При отсутствии либидо сперму можно собирать специальными методами и использовать для искусственного осеменения, но такая практика способствует передаче дефекта потомству, а потому неэтична. Кобели с нормальными показателями спермыДанные приведены на фиг. 8.2. Занимаясь подготовкой к вязке здоровых кобелей с суками, подтвердившими свою фертильность, принимают меры для правильной организации племенной работы с учетом индивидуальных особенностей суки. Для корректного определения сроков вязки проводят обследование суки, с помощью зеркала устанавливают наличие изменений слизистой оболочки влагалища, характерных для стадии проэструса, в вагинальных выделениях измеряют концентрацию прогестерона (см. следующую главу). Беременность и численность помета определяют на 25–28 день после овуляции. В случае бесплодной вязки мазки и образцы спермы в растворе формалина следует отослать в специализированную лабораторию для электронной микроскопии и анализа дефектов спермы, способных вызывать бесплодие. Диагностику вероятных хромосомных нарушений также осуществляют в специализированной лаборатории на основании кариотипирования лимфоцитов периферической крови. 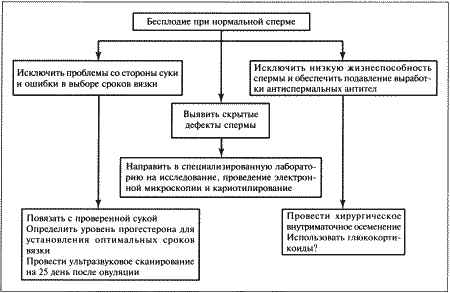 Фиг. 8.2. Фиг. 8.2. Лечение бесплодия у кобелей с нормальными параметрами спермы При низкой жизнеспособности спермы или при наличии у ценного кобеля антиспермальных антител рекомендуется хирургическое внутриматочное осеменение. На соответствующем этапе эструса в каждый из рогов матки помещают половину объема эякулята. Иммуносупрессивная терапия с применением глюкокортикоидов для снижения выработки антиспермальных антител на собаках не испытана; вполне вероятно, что такое лечение способно положительно влиять на сперматогенез, если не принимать во внимание возможные побочные явления. Кобели с низким качеством спермыПрогноз часто неблагоприятный (фиг. 8.3). Лечение и уход направлены на восстановление фертильности до уровня, при котором самец может быть ограниченно использован как производитель. Выбор методов лечения определяется затратами и наличием соответствующего оборудования. В качестве альтернативы клиенту можно посоветовать тщательно придерживаться рекомендаций, приведенных на фиг. 8.3. 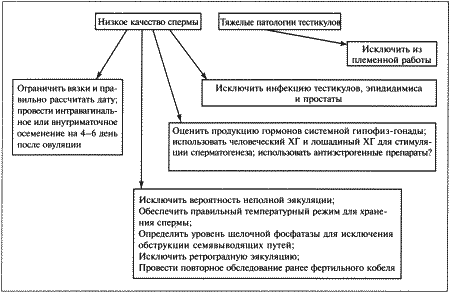 Фиг. 8.3. Фиг. 8.3. Лечение кобелей с низким качеством спермы Азооспермия, олигозооспермия и тератозооспермия1. Обеспечить сбор эякулята в полном объеме, провести повторный анализ, особенно если речь идет о самце, до недавнего времени не страдавшем бесплодием. 2. После сбора спермы отобрать мочу на анализ для исключения ретроградной эякуляции в мочевой пузырь. 3. Определить уровень щелочной фосфатазы в нескольких эякулятах для исключения блокировки протоков, например двусторонней гранулемой (<10 000 МЕ/л). 4. Исключить тестикулярную гипоплазию, патологические факторы, вызывающие их дегенерацию, и связанную с возрастом недостаточность половых желез. 5. Исключить инфекции репродуктивного тракта, придерживаясь описанного выше протокола. При наличии хронического бактериального орхита или эпидидимита и хронического бактериального простатита назначить антибиотики (4–12 недель). Простатит трудно поддается лечению из-за плохой проницаемости железы для антибиотиков, поэтому рекомендуется выбирать препараты с низкой способностью связывания с белком и высокой жирорастворимостью (хлорамфеникол и фторохинолоны). Перед началом лечения определяют рН секрета предстательной железы (в норме секрет нейтральный или слабо кислый). Это важно, так как слабощелочные антибиотики (эритромицин и триметоприм-сульфа) могут достигать высокой концентрации в предстательной железе. 6. Оценить продукцию гормонов в системе гипофиз-семенники, уделив особое внимание активности клеток Лейдига, поскольку низкая концентрация тестостерона может обусловливать морфологические дефекты спермиев. Если при первичной дисфункции тестикулов наблюдается низкий уровень тестостерона и повышенные концентрации ЛГ и/или ФСГ или повышенный уровень ФСГ при нормальных показателях тестостерона и ЛГ, лечение бесперспективно. Собак с низким уровнем тестостерона и гонадотропинов исследуют на наличие опухолей гипофиза. При низкой активности гонадотропинов, проявляющейся в нарушении сперматогенеза, рекомендуют стимуляцию клеток Лейдига с применением человеческого ХГ (500МЕ подкожно дважды в неделю) и лошадиного ХГ (20 МЕ/кг подкожно 3 раза в неделю). Лечение продолжают около 3 месяцев. 7. Провести исследование спермы, по крайней мере, за неделю до вязки, поскольку повторные вязки у кобелей, страдающих олигозо-оспермией, могут вызывать азооспермию. Имеются сообщения об успешном лечении олигозооспермии у людей антагонистами эстрогенов (кломифеном, тамоксифеном). В редких случаях некоторое улучшение параметров спермы достигается назначением синтетических андрогенов (местеролона, 0,75–1,5 мг/кг). 8. При олигозооспермии следует тщательно устанавливать сроки вязок, ограничивая их количество. При снижении концентрации спермы хорошие результаты дает вагинальное или хирургическое искусственное осеменение. При количестве спермиев в эякуляте более 100 х 106 вагинальное искусственное осеменение проводят на 4–6 день после пика ЛГ, дату которого устанавливают на основании данных об изменении концентрации прогестерона. В случае неудачи или при низком, но не менее 20 х 106 количестве спермиев в эякуляте хирургическое искусственное осеменение проводят на 5 день после пика ЛГ. 9. Для других видов животных при двусторонней спермальной гранулеме применяют хирургическое осеменение аспиратом эпидидимиса, содержащим жизнеспособные спермии, однако на собаках метод не отработан. Астенозооспермия1. Исключить инфекционные заболевания, в случае необходимости провести лечение. 2. Исключить возможность неполной эякуляции. 3. Исключить контаминацию спермы мочой (проследить за тем, чтобы собака опорожнила мочевой пузырь перед забором спермы). 4. Обеспечить сбор и анализ образца спермы при соответствующем температурном режиме. 5. Не использовать кобеля в разведении в течение 2 месяцев, затем провести повторное исследование. ИССЛЕДОВАНИЯ И ПРИЧИНЫ БЕСПЛОДИЯ КОТОВ Для выявления причин бесплодия необходимо получить сведения о пациенте, в том числе и о его репродуктивной активности. Получить такие данные о котах может быть весьма непросто, однако для выбора адекватного лечения ветеринарный врач должен представлять серьезность проблемы (длительность, тяжесть проявлений). Проводят общий клинический осмотр, включающий осмотр органов репродуктивной системы. Семенники в норме безболезненны, имеют сферическую форму, одинаковую величину и однородную консистенцию. В случае выявления воспалительных процессов и травм назначают соответствующее лечение. Инфекционный перитонит может вызывать орхит и дегенерацию тестикулов у котов. Крипторхизм чаще наблюдается у чистопородных животных и как у других видов может сопровождаться аспермией. При тяжелых формах орхита и при крипторхизме показана кастрация. Отмечены случаи тестикулярной гипоплазии в результате хромосомных нарушений (38 XY/57, XXY у котов черепахового или белого окраса, а также 38, XXY). Пенис кота располагается в свободном препуции и направлен назад. Кость полового члена не имеет желоба. На двух третях краниального отдела пениса расположены 100–200 ороговевших остистых отростков, предназначенных для стимуляции влагалища самки во время коитуса и увеличения числа овуляций. Отмечены случаи дифаллоса (двойная головка полового члена) и сохранения уздечки полового члена. У котов часто наблюдается обструкция уретры, которая может быть связана с образованием гематомы. Неудачи при вязке иногда объясняются тем, что вокруг головки полового члена свалялась шерсть. В таком случае шерсть удаляют. Сбор и анализ спермы Искусственная вагинаПосле двухнедельной тренировки около 20 % котов привыкают к искусственной вагине (ИВ). Для изготовления ИВ используют резиновый «палец» (снятый с 1–2 мл стеклянной пипетки), который надевают на пробирку 3 х 44 мм; все приспособление помещают в полиэтиленовый 60-миллилитровый флакон, наполненный водой с температурой 52 ?С; второй, закругленный конец «пальца» обрезают, натягивают его на край флакона и фиксируют. Для стимуляции самца необходимо присутствие течной самки, дополнительную стимуляцию оказывает надавливание ладонью на область таза. После достижения эрекции ИВ надевают на пенис и через 1–4 минуты собирают эякулят. ЭлектроэякуляцияПри необходимости процедуру проводят под общей анестезией, в качестве анестетиков назначают кетамина гидрохлорид (10 мг/кг) в сочетании с ксилазином (2 мг/кг) или кетамин гидрохлорид (5 мг/кг) в сочетании с медетомидином (80 мг/кг). Для быстрого выхода из анестезии назначают Atipamamezol. Смазанный тефлоновый ректальный зонд 10 х 12 см, снабженный тремя электродами из нержавеющей стати длиной по 5 см, вводят в прямую кишку приблизительно на 6 см. Стимуляция обеспечивается серией импульсов напряжением 2–8 вольт при силе тока 5–220 мА. Серия включает 60 импульсов с интервалом 2 сек. Методика исследования спермы аналогична применяемой для собак. Нормальные значения параметров приведены в табл. 8.2. Другие причины бесплодия Отсутствие либидоНовая незнакомая обстановка, помещение в клетку или агрессивное поведение кошки могут спровоцировать временное или постоянное снижение либо утрату либидо. Скудный рацион или ожирение также являются причинами подобного нарушения. Устранение причины приводит к восстановлению либидо, однако при врожденном нарушении лечение считают неэтичным в связи с наследственным характером дефекта. Табл. 8.2. Нормальные значения параметров спермы котовНевозможность совершить вязку Если при наличии возбуждения кот не может совершить вязку, причина может заключаться в том, что в области пениса свалялась шерсть и появились колтуны (см. выше). Ретроградная эякуляцияВ литературе имеются сведения о ретроградной эякуляции у котов, однако лечение не разработано. ЛИТЕРАТУРА Axner E., Strom В., Linde-Forsberg С., Gustavsson I., Lindblad К. and Wallgren M. (1996) Reproductive disorders in 10 domestic male cats. Journal of Small Animal Practice 37, 394–401. Burke T. J. (1986) Small Animal Reproduction and Fertility. Lea and Febiger, Philadelphia. Christiansen I. B. J. (1984) Reproduction in the Dog and Cat. Bailliere Tindall, London Ellington J. E. (1994) Diagnosis, treatment and management of poor fertility in the stud dog. Seminars in Veterinary Medicine and Surgery (Small Animal) 9, 46–53. England G. C. W. (1996) Reproductive biology in the male dog. The Veterinary Annual 36, 187–201. Feldman E. C. and Nelson R. W. (1996) Canine and Feline Endocrinology and Reproduction, 2nd edition. W. B. Saunders, Philadelphia. Johnston G. R., Feeney D. A., River B., and Walter P. A. (1991) Diagnostic imaging of the male canine reproductive organs: methods and limitations. Veterinary Clinics of North America Small Animal Practice 21, 553–589. Johnston S. D. (1991) Performing a complete canine semen evaluation in a small animal hospital. Veterinary Clinics of North America Small Animal Practice 21, 545–551. Meyers-Wailen V. N. (1991) Clinical approach to infertile male dogs with sperm in the ejaculate. Veterinary Clinics of North America: Small Animal Practice 21, 609–633. Olson P. N. (1991) Clinical approach for evaluating dogs with azoospermia or aspermia. Veterinary Clinics of North America: Small Animal Practice 21, 591–608. Root M. V. and Johnston S. D. (1994) Basics for a complete reproductive examination of the male dog. Seminars in Veterinary Medicine and Surgery Small Animal 9, 41–45. Sakamoto Y., Matsumoto T., Mizunoe Y., Haraoka M., Sakumota M. and Kumazawa J. (1995) Testicular injury induces cell-mediated autoimmune response to testis. Journal of Urology 153, 1316–1320. Wallace M. S. (1992) Infertility in the male dog. Problems in Veterinary Medicine 4, 531–544. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||
