|
||||
|
|
ГЛАВА 10 Вязка и искусственное осеменение у кошек Е. Акснер (Eva Axner) ВВЕДЕНИЕ Для племенного разведения отбирают животных, соответствующих породным стандартам, лишенных дефектов и отличающихся хорошим темпераментом. Кошки должны иметь в прошлом неосложненные роды и обладать выраженным материнским инстинктом. Целью племенного разведения является получение здоровых котят, а не нескольких выставочных экземпляров, выбранных из помета, имеющего врожденные дефекты или отклонения от породных стандартов. Инбридинг может в течение определенного периода времени способствовать рождению котят с превосходным экстерьером, однако в дальнейшем становится причиной врожденных дефектов, практиковать его не рекомендуется, особенно при разведении редких, малочисленных пород. Для того, чтобы дифференцировать репродуктивные проблемы, обусловленные ошибками в содержании, от патологий репродуктивного тракта, необходимо понимать сущность физиологических процессов, обеспечивающих репродуктивное поведение и механизм овуляции. Инфекционные заболевания часто вызывают репродуктивные нарушения, поэтому от заводчика требуются серьезные усилия, направленные на предотвращение их распространения. Перед вязкой проводят обследование обоих партнеров, выявляя признаки заболеваний, а также вероятные дефекты, имеющие наследственный характер. Уничтожают внешних и внутренних паразитов. Рекомендуется проведение тестов на наличие вирусов лейкемии и иммунодефицита кошек. Племенные животные должны быть вакцинированы от герпесвирусной и калицивирусной инфекций и панлейкопении. Проведение андрологического и гинекологического обследования перед вязкой не практикуется, однако рекомендуется осматривать семенники и пенис самца. Если в анамнезе имеются указания на нарушения репродуктивной функции, обследование, включая анализ спермы, проводят с большей тщательностью. ВЯЗКА Поведенческий эструсПоведенческий эструс у кошек объясняется повышением концентрации эстрадиола, вырабатываемого развивающимися фолликулами. Проэструс непродолжителен (1–2 дня) и не всегда явно выражен. Кошка кричит, трется о различные предметы и хозяев, проявляет беспокойство, однако не подпускает к себе самца. После начала эструса крики становятся монотонными и настойчивыми, кошка трется головой, катается по полу, принимает характерную позу: поднимает круп и припадает грудью к земле. На данной стадии часто наблюдаются прозрачные вагинальные выделения. Характерное поведение самки (позу лордоза, переступание задними лапами и отведение хвоста в сторону) можно спровоцировать, поглаживая круп или взяв животное за холку (фиг. 10.1). Как правило, у кошки наблюдается снижение аппетита и учащенное мочеиспускание. Однако у некоторых кошек поведенческий эструс выражен незначительно или отсутствует, несмотря на повышенную концентрацию эстрадиола и активность фолликулов, подтвержденные анализом крови или вагинальных выделений. Интенсивность поведенческого эструса связана с породой (у ориентальных пород эструс более выражен по сравнению с персидскими). 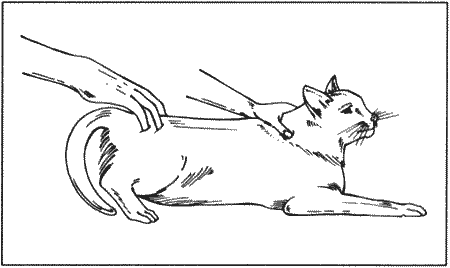 Фиг. 10.1. Фиг. 10.1. Позу лордоза и переступание задними лапами можно спровоцировать, взяв кошку за холку и поглаживая основание хвоста или перинеальную область 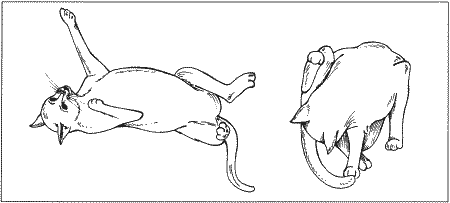 Фиг. 10.2. Фиг. 10.2. Пост-коитальная реакция кошки включает катание по полу и вылизывание гениталий Поведение во время вязкиКошка привлекает кота с помощью криков, запаха и характерного поведения. Перед садкой кот сжимает зубами холку кошки и переступает задними лапами, часто прикасаясь к перинеальной области кошки, побуждая ее принять характерную позу. Интромиссия продолжается всего несколько секунд (от 3 до 30), при этом сперма попадает во влагалище. По окончании вязки кошка издает характерный крик, повышающийся до пронзительного визга. Опытный кот поспешно ретируется на безопасное расстояние, поскольку кошка нападает на него, если он держится поблизости. Так называемый копуляционный крик и агрессия по отношению к коту являются частью пост-коитальной реакции кошки, к которой относятся катание по полу и вылизывание гениталий (фиг. 10.2). Часто кошка подпускает кота для следующей садки уже через 10 минут, хотя этот интервал может растянуться до часа. Отсутствие пост-коитальной реакции свидетельствует о том, что интромиссия не состоялась. Вероятно, такая реакция самки объясняется стимуляцией вагины остистыми выростами (шипиками) на пенисе кота. ОвуляцияКоитус стимулирует выработку гипоталамусом ГнРГ, вызывающего в свою очередь продукцию лютеинизирующего гормона ЛГ гипофизом. Овуляция происходит по достижении определенной концентрации Л Г. Репродуктивное поведение кошек характеризуется неоднократными коитусами, поскольку однократный коитус не обеспечивает достаточного выброса ЛГ и овуляции. Чаще всего необходимое повышение концентрации ЛГ наблюдается после четырех вязок. Начало эструса может не совпадать со способностью вырабатывать ЛГ в ответ на коитус, поэтому вязка в первый или во второй день эструса не всегда вызывает овуляцию, что, вероятно, объясняется недостаточной зрелостью ооцитов. После повышения концентрации ЛГ до необходимого уровня одновременно овулируют все зрелые ооциты. Обычно это случается через 26–29 часов, считая от вязки, происходившей на фоне высокой концентрации ЛГ. Последние данные позволяют предположить, что спонтанная овуляция бывает гораздо чаще, чем принято считать (у 35 % кошек из 20 исследованных особей). Пробы прогестерона, взятые через неделю после вязки, позволяют установить, произошла ли овуляция. Концентрация прогестерона на базальном уровне указывает на отсутствие вязки, недостаточное количество интромиссий или вязку, состоявшуюся слишком рано или слишком поздно. Уровень прогестерона > 15 нмоль/л (>5 нг/мл) подтверждает факт овуляции. Продолжительный интервал интерэструса также свидетельствует об овуляции, хотя не у всех кошек наблюдается регулярный цикл. Организация вязкиСогласно общепринятой практике вязку проводят в привычном для кота окружении, поэтому, как правило, кошек доставляют к производителю. Если кот спокоен и опытен, а кошка излишне пуглива, можно поступить наоборот. Животным следует предоставить возможность привыкнуть друг к другу и освоиться в незнакомом месте; приглушенное освещение помогает создать ощущение безопасности. Если кошка неопытна, пуглива и не подпускает кота, ее можно поднести к нему, взяв за холку и поглаживая перинеальную область, тем самым стимулируя ее, принять характерную позу и побуждая самца совершить садку. Для обеспечения овуляции животных не следует разлучать до третьего дня эструса и совершения, по крайней мере четырех коитусов. Об их завершении судят по посткоитальной реакции самки. В пару неопытному коту выбирают опытную и спокойную кошку, тогда как для неопытной кошки предпочтительнее вязка с опытным котом. Однако в некоторых случаях взрослые самки могут отвергать молодого, неопытного самца. Вероятные проблемы, наблюдающиеся в ходе вязки, приведены в таблице 10.1. Табл. 10.1. Проблемы, наблюдающиеся в ходе вязки, и их решение
СБОР И АНАЛИЗ СПЕРМЫ Сбор спермыСперму собирают с помощью искусственной вагины или электроэякуляции. Кроме двух названных методов практикуется лаваж влагалища после вязки или извлечение сперматозоидов из хвоста придатка после кастрации. Искусственная вагинаИскусственную вагину изготавливают из резинового «пальца» от пипетки Пастера и небольшой пробирки (фиг. 10.3). Самцу позволяют сделать садку на течную самку и подносят искусственную вагину, направив в нее пенис самца (фиг. 10.4). К недостаткам данного метода можно отнести необходимость присутствия возбужденной самки, а также невозможность проведения манипуляции без предварительной подготовки самца, занимающей 2–3 недели. Процедура завершается успехом лишь в 2/3 случаев. Сбор спермы с помощью искусственной вагины эффективен при работе с лабораторными животными, но редко практикуется в клинических условиях. 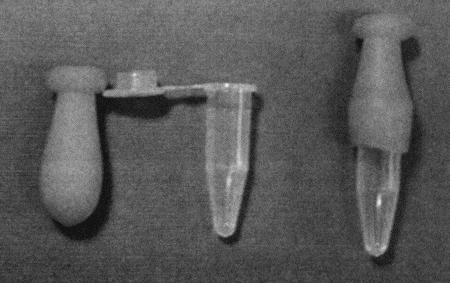 Фиг. 10.3. Фиг. 10.3. Искусственная вагина для сбора спермы состоит из резинового «пальца» и пробирки 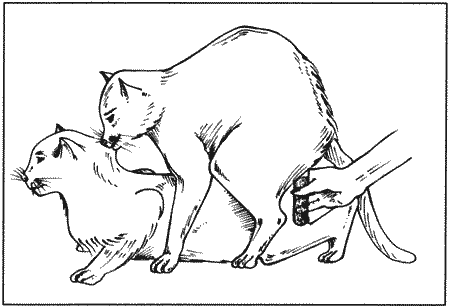 Фиг. 10.4. Фиг. 10.4. Получение спермы с помощью искусственной вагины ЭлектроэякуляцияМанипуляция не требует предварительной подготовки кота, однако проводится под общей анестезией для того, чтобы животное не испытывало неприятных ощущений. В прямую кишку вводят ректальный зонд (1 x 12 см), изготовленный из нетоксичного пластика и соединенный с электрическим стимулятором (фиг. 10.5). Зонд снабжен тремя электродами (1,5 мм х 5 см), два из которых (наружные) соединяют между собой, а центральный имеет противоположную полярность. Для предотвращения попадания слизистой прямой кишки между зондом и электродами последние должны плотно прилегать к корпусу зонда. Лаборатория автора использует электроэякулятор, работающий на частоте 50 Гц, снабженный трансформатором, обеспечивающим продолжительные импульсы мощностью от 0 до 30 вольт. Прибор работает от источника напряжения 220 вольт. Сила тока и напряжение регулируются с помощью вольтметра и амперметра.  Фиг. 10.5. Фиг. 10.5. Оборудование для электроэякуляции у котов. Электрический стимулятор и ректальный зонд с тремя электродами После проведения анестезии зонд смазывают и осторожно вводят в прямую кишку на 7–9 см, направляя электроды вентрально. Пенис обнажают легким нажатием на его основание и подносят к нему лабораторную пробирку. Серия из 80 импульсов мощностью от 2 до 5 вольт обеспечивает эякуляцию (табл. 10.2). Общая последовательность манипуляций включает три серии: 30 стимуляций (по 10 при 2, 3 и 4 вольтах), 30 стимуляций (по 10 при 3, 4 и 5 вольтах) и 20 стимуляций (по 10 при 4 и 5 вольтах). Между сериями делают паузы продолжительностью 2–3 минуты. Стимуляцию начинают, повышая напряжение в течение 1 секунды с 0 вольт до требуемого, после чего выдерживают 2–3 секунды при этом напряжении и резко снижают его до 0, снова выдерживая 2–3 секунды. Существуют иные методики, предусматривающие другие напряжения и длительность стимуляций. Каждый разряд сопровождается реакцией, выражающейся в вытягивании задних конечностей, что указывает на адекватность раздражения. Отсутствие реакции при напряжении 2 вольт и более свидетельствует о неправильном положении электродов или о наличии в прямой кишке каловых масс. В ходе эякуляции часть сперматозоидов попадает в мочевой пузырь, эта особенность эякуляторного процесса является нормой для домашних кошек, но может усиливаться в результате применения альфа-2 стимуляторов адренорецепторов (ксилазин и медетомидин) для седации. Табл. 10.2. Методика проведения электроэякуляции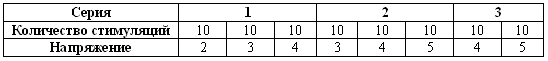 Вагинальный лаваж после вязки Вагинальный лаваж после вязки Метод не распространен в клинической практике, поскольку лишь немногие коты способны к вязке в незнакомом месте, тем более в клинике. Другой недостаток метода заключается в необходимости назначения кошке седативных препаратов, а также в том, что секрет влагалища и жидкость, используемая для процедуры (солевой раствор, подогретый до 37 °C), могут влиять на качество спермы. Метод практикуют при невозможности получить сперму с применением искусственной вагины или электроэякуляции. Сбор спермы из эпидидимисаПосле кастрации сперму получают из хвоста придатка путем вымывания сперматозоидов из протока придатка или измельчения хвоста придатка. Метод применяют при сборе спермы для научных исследований или при необходимости сохранить сперму редкого вида диких животных, погибших в неволе или в результате несчастного случая. Табл. 10.3. Оценка качества спермыВсе материалы, соприкасающиеся со спермой, должны быть подогреты до 37 ?С для предотвращения холодового шока ЦветНормальное качество спермы У котов объем эякулята небольшой (до 0,01–0,77 мл). Если сперму собирают с помощью электроэякуляции, то из-за более интенсивной стимуляции добавочных желез ее объем заметно больше, чем при получении с помощью искусственной вагины. Общее количество сперматозоидов в эякуляте составляет от 3 х 106 до 153 х 106, обычно оно выше, когда сперму собирают с помощью искусственной вагины, чем если ее получают методом электроэякуляции. Подвижность сперматозоидов различна и может быть связана с продолжительностью сексуального воздержания. Осмоляльность свежей спермы, собранной с помощью искусственной вагины, составляет около 320 мосм/кг и возрастает при хранении. Сперма содержит много алкалин фосфатазы, ее рН колеблется между 6,6 и 8,77. Содержание нормальных сперматозоидов на уровне 60 % и более считают нормой, при показателе менее 40 % можно говорить о тератозооспермии. Однако связь между качеством спермы и фертильностью у домашних кошек нуждается в дальнейшем изучении. В естественных условиях нормальная фертильность наблюдается и при менее чем 40 % содержании нормальных сперматозоидов в эякуляте. Если сперму получают методом электоэякуляции два раза за короткий промежуток времени, то во втором образце, как правило, отмечается большая подвижность и более высокий процент здоровых сперматозоидов. Был проведен эксперимент: от 15 котов разных пород 2 раза за время одной анестезии брали сперму методом электроэякуляции. Оказалось, что количество здоровых сперматозоидов в первом эякуляте составляет 40,9 %, тогда как во втором возрастает до 54,6 %, притом что первый эякулят отличается более высокой концентрацией. Из изложенного следует, что для определения фертильности целесообразно проводить несколько анализов спермы. ХРАНЕНИЕ СПЕРМЫ И ИСКУССТВЕННОЕ ОСЕМЕНЕНИЕ Хранение спермыСперму сохраняют в течение 24–48 часов в охлажденном буферном растворе. Если предполагается длительное хранение, ее замораживают. В большинстве случаев определение параметров спермы после хранения проводят in vitro, хотя данных об успешном оплодотворении кошек спермой, подвергавшейся длительному хранению, немного. Охлажденная разбавленная спермаВ связи с тем, что качество спермы котов исследуют in vitro, результаты осеменения предсказать трудно. Для хранения спермы при температуре 4–5 °C применяют Test-T буфер (табл. 10.4), содержащий 20 % яичного желтка и 5 % глицерина. Хранение приводит к снижению подвижности сперматозоидов и процентного соотношения неповрежденных акросом. Повышенное содержания желтка и Сахаров снижает подвижность сперматозоидов при хранении, поэтому простой TesT-буфер, не содержащий Сахаров или желтка, вполне пригоден для разбавления спермы. Табл. 10.4. TesT-буфер
* Tes доводится до рН 7,4 This буфером. Желток и глицерин добавляют в случае, если раствор предполагается использовать для замораживания спермы (при охлаждении это необязательно). Табл. 10.5. Буферный раствор, содержащий желток и лактозуЗамораживание спермы Сперму котов замораживают в желточно-лактозном буфере (табл. 10.5). Замораживание в гранулах и пайеттах дает сопоставимые результаты в отношении сохранения подвижности сперматозоидов, доли сперматозоидов с неповрежденным акросомами, проникновения через zona pellucida и связывания с оолеммой. Свежую сперму разбавляют раствором Ham's F 10 в соотношении 1:3 (с добавлением 5 % эмбриональной сыворотки телят), центрифугируют, затем смешивают с буфером. Разбавленную сперму помещают в 0,25 мл пайетты, оставляют на 10 минут при температуре 22 °C и на 60 секунд вручную опускают в пары жидкого азота, охлаждают там до -10 °C, после чего замораживают до -100 ?С, понижая температуру со скоростью -40 °C/мин, затем опускают в жидкий азот. Сперму размораживают в течение 10 секунд на воздухе, затем в течение 20 секунд на водяной бане при температуре 37 °C, после чего смешивают с раствором Ham's F 10. Кроме названного раствора, для разбавления спермы применяют буферы TesT и Трис. Подвижность сперматозоидов и количество неповрежденных акросом снижаются после размораживания. Использование искусственного осемененияРаботы по искусственному осеменению домашней кошки проводятся преимущественно в научных целях, поскольку ее биология имеет сходство с биологией диких кошачьих, однако разработанные методы искусственного осеменения и сохранения спермы могут найти применение в племенном разведении кошек. Численность племенных животных у многих пород ограничена, в частности, из-за того, что большинство котов подвергается кастрации в связи с поведенческими проблемами (например, нанесения мочевых меток), осложняющими их содержание в домашних условиях. Недостаток производителей, а также дисбаланс численности некастрированных кошек и котов рано или поздно приводит к инбридингу и дегенерации, что оборачивается распространением врожденных дефектов и заболеваний. Замораживание спермы позволяет обеспечить не только ее экспорт в любую страну мира, но и возможность получать потомство даже от кастрированных или погибших котов. Кроме того, искусственное осеменение значительно снижает риск распространения заболеваний. Методы искусственного осеменения Индукция овуляцииВ отсутствие вязки овуляцию стимулируют посредством инъекции человеческого ХГ, повышающего секрецию ЛГ. Индукция овуляции наиболее эффективна на 3 день эструса. Внутримышечное введение 100 ME человеческого ХГ обеспечивает овуляцию у большинства кошек, повышение дозы приводит к гиперстимуляции яичников и дегенерации ооцитов. Анестезия угнетают овуляцию, если проводится после ее индукции или непосредственно перед овуляцией. В качестве альтернативного метода можно использовать внутримышечное введение 25 мкг ГнРГ. Искусственное осеменение свежей спермойИмеются сообщения об успешном осеменении свежей спермой (как вагинальном, так и внутриматочном). Если осеменение спермой, разбавленной 0,1 мл физраствора, проводят в день введения человеческого ХГ и повторно через 24 часа, т. е. в момент овуляции, обеспечивается более надежное оплодотворение по сравнению с однократным осеменением в день введения человеческого ХГ. Хирургическое внутриматочное осеменение обеспечивает наилучшие результаты, если проводится через 31–50 часов после введения человеческого ХГ. Оплодотворение происходит в течение 49 часов после индукции овуляции. Для выполнения интравагинального осеменения назначение транквилизаторов обычно не требуется. Длина преддверия влагалища домашней кошки составляет 1–2 см, диаметр 2,5–3,0 см. Французский катетер калибра 3,5 может быть использован для интравагинального осеменения. Его вводят на 45–50 мм во влагалище до шейки матки, выдавливают сперму (фиг. 10.6), после чего в течение 10 минут животное удерживают в положении с приподнятой тазовой частью. Для осеменения свежей спермой в спермодозе должно содержаться не менее 5 х 106 сперматозоидов. Табл. 10.6. Искусственное осеменениеИскусственное осеменение замороженной спермой Полноценное потомство можно получить с помощью осеменения замороженной (после ее размораживания) спермой. Вероятность наступления беременности составляет около 10 % при естественной и гормональной стимуляции течки. Низкая эффективность такого метода объясняется, вероятно, повреждениями акросом в процессе замораживания и последующего размораживания, даже если сперматозоиды отличаются хорошей подвижностью. Важным фактором является корректный выбор как времени проведения манипуляции, так и метода осеменения: как и у собак, наилучшие результаты наблюдаются в результате внутриматочного осеменения, особенно если речь идет об использовании замороженной спермы. Хирургическое внутриматочное осеменение не практикуется во многих странах в связи с этическими соображениями. Внутриматочное осеменение через шейку матки значительно повышает результативность данной процедуры. Искусственное осеменение, в том числе получение и хранение спермы не является распространенным методом племенной работы, однако может стать таковым в самом ближайшем будущем. 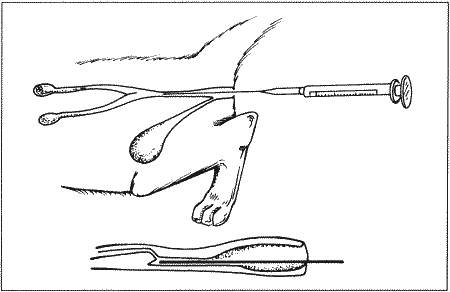 Фиг. 10.6. Фиг. 10.6. Вагинальное осеменение кошки. Сперму вводят в краниальный отдел влагалища ближе к шейке матки ЛИТЕРАТУРА Axner E., Strom В. and Linde-Forsberg С. (1997) Sperm morphology is better in the second ejaculate than in the first in domestic cats electroejaculated twice during the same period of anesthesia. Theriogenology, 47, 929–934. Axner E., Strom B., Linde-Forsberg C., Gustavsson I., Lindblad К. and Wallgren M. (1996) Reproductive disorders in 10 domestic male cats. Journal of Small Animal Practice 37, 394–401. Chakraborty P. K., Wildt D. E. and Seager S. W. J. (1979) Serum luteinizing hormone and ovulatory response to luteinizing hormone-releasing hormone in the estrous and anestrous domestic cat. Laboratory Animal Science 29, 338–344. Dooley M. P. and Pineda M. H. (1986) Effect of method of collection on seminal characteristics of the domestic cat. American Journal of Veterinary Research 47, 286–292. Dooley M. P., Pineda M. H., Hopper J. G. and Hsu W. H. (1991) Retrograde flow of spermatozoa into the urinary bladder of cats during electroejaculation, collection of semen with an artificial vagina, and mating. American Journal of Veterinary Research 52, 687–691. Glover T. T. and Watson P. F. (1985) The effect of buffer osmolality on the survival of cat (Felis catus) spermatozoa at 5 °C. Theriogenology, 24, 449–456. Glover T. T. and Watson P. F. (1987) The effects of egg yolk, the low density lipoprotein fraction of egg yolk, and three monosaccharides on the survival of cat (Felis catus) spermatozoa stored at 5 °C. Animal Reproduction Science 13, 229–237. Linde-Forsberg С. (1990) Achieving pregnancy by using frozen canine chilled extended semen. Veterinary Clinics of North America-Small Animal Practice 21, 467–485. Platz C. C. and Seager S. W. J. (1978) Semen collection by electroejaculation in the domestic cat. Journal of the American Veterinary Association 173, 1353–1355. Platz C. C., Wildt D. E. and Seager S. W. J. (1978) Pregnancy in the domestic cat after artificial insemination with previously frozen spermatozoa. Journal of Reproduction and Fertility 52, 279–282. Pope C. E., Turner J. L., Quatman S. P. and Dresser B. L. (1991) Semen storage in the domestic felid: a comparison of cryopreservation methods and storage temperatures. Biology of Reproduction 44, 257, 50. Sojka N. J., Jennings L. L. and Hamner C. E. (1970) Artificial insemination in the cat (Felis catus L.). Laboratory Animal Care 20, 198–204. Watson P. F. and Glover T. E. (1993) Vaginal anatomy of the domestic cat (Felis catus) in relation to copulation and artificial insemination. Journal of Reproduction and Fertility Supplement 47, 355–359. Wood T. C., Swanson W. F., Davis R. M., Anderson J. E. and Wildt D. E. (1993) Functionality of sperm from normo-versus teratospermic domestic cats cryopreserved in pellets or straw containers. Theriogenology 39, 342. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||
