|
||||
|
|
ГЛАВА 17 Фармакологический контроль репродукции у кошек Дж. Верстеген (John P. Verstegen) ВВЕДЕНИЕ Специальные знания о применении медикаментозной терапии для лечения кошек весьма ограничены, это касается и репродуктивной деятельности. Во многих случаях схемы назначения препаратов отличаются от таковых для собак. Тем не менее возросший объем знаний о репродуктивной биологии собак, в том числе о ряде лекарственных средств, например, о простагландинах или антипролактиновых препаратах может быть использован и при работе с кошками. Целью данной главы является обзор основных клинических проблем, обусловленных нарушениями репродуктивной функции у кошек и основных категорий лекарственных препаратов, применяемых для их лечения (табл. 17.1). КОШКИ Индукция эструса, бесплодие, суперовуляцияИндукция роста фолликулов, поведенческого эструса и овуляции легко достижимы у кошек. Показаниями к стимуляции являются задержка полового созревания, затянувшийся анэструс; кроме того, ее проводят с целью синхронизации эструса. Задержка полового развитияВажно своевременно поставить такой диагноз, поскольку начало пубертата варьирует в зависимости от индивидуальных особенностей и породы животного. Породистые длинношерстные кошки достигают зрелости не ранее, чем в 18–24 месяца, поэтому диагноз ставят на основании результатов клинического исследования и подробного анамнеза. Увеличение продолжительности анэструсаПродолжительный анэструс может быть обусловлен приемом прогестагенов; иногда анэструс ошибочно считают продолжительным из-за некорректной диагностики эструса. Важно помнить о том, что у кошек реакция на индукцию эструса очень хорошая, и излишняя стимуляция может вызывать суперовуляцию или продукцию множества неовулировавших фолликулов кистозного характера. Особенно данная реакция свойственна молодым животным или кошкам препубертатного возраста. Существует целый ряд методик стимуляции эструса, которые приведены в таблице 17.2. Автор настоящей главы отдает предпочтение следующей схеме: 100 ME гонадотропина, полученного из сыворотки жеребых кобыл (также называемого лошадиным ХГ), однократно вводят в период анэструса, после чего с интервалом в 5–7 дней назначают инъекцию человеческого ХГ (50 ME). Такая схема обеспечивает овуляцию, и результаты последующей вязки сравнимы с результатами естественной вязки. Необходимо отметить, что повторные инъекции экзогенного гонадотропина могут вызывать продукцию антител к лошадиному ХГ, что приводит к снижению реакции на стимуляцию. В связи с этим повторное применение приведенной схемы не рекомендуется. В случае продолжительного анэструса у собак индукция эструса успешно достигается введением имплантанта, содержащего бузерелин, или антагонистов пролактина. Применение этих препаратов для кошек нуждается в дальнейшем изучении. Согласно последним сведениям, полученным в нашей лаборатории, назначение каберголина, агониста дофамина, в дозе 5 мкг/кг ежедневно обеспечивает наступление фертильного эструса у кошек и собак. Применение ГнРГ рекомендуется в дозе 1 мкг/кг подкожно до наступления признаков поведенческого эструса, максимальный курс — до 10 дней. Предотвращение и/или подавление эструсаТрадиционно для контроля и/или подавления эструса у кошек применяют прогестагены. Побочные эффекты сходны с наблюдаемыми у собак (заболевания матки, увеличение веса, опухоли молочных желез, адренокортицизм и сахарный диабет). Табл. 17.1. Гормоны и их аналоги, применяемые для кошек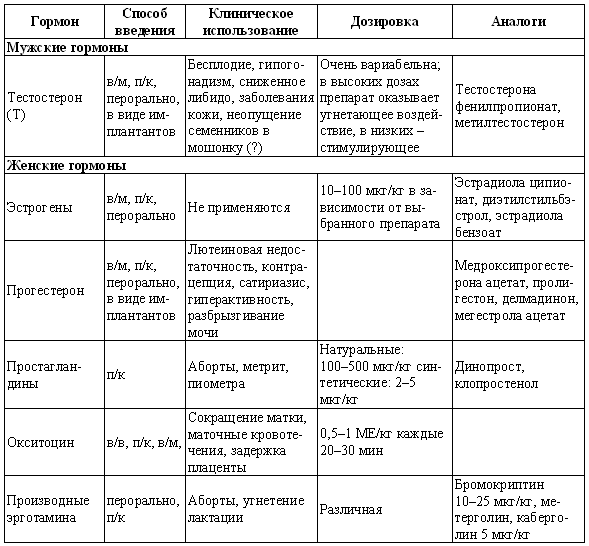 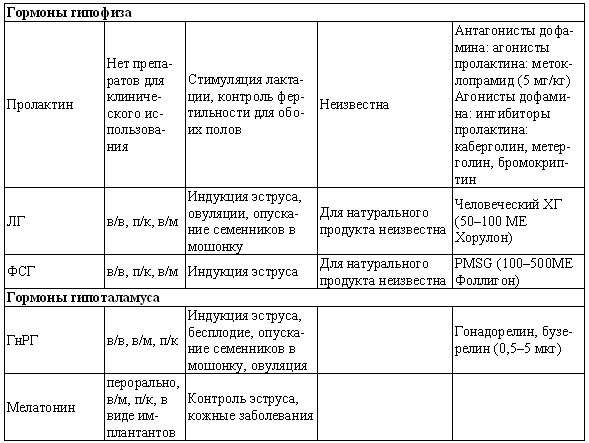 Табл. 17.2. Протоколы индукции эструса у кошек Табл. 17.2. Протоколы индукции эструса у кошек 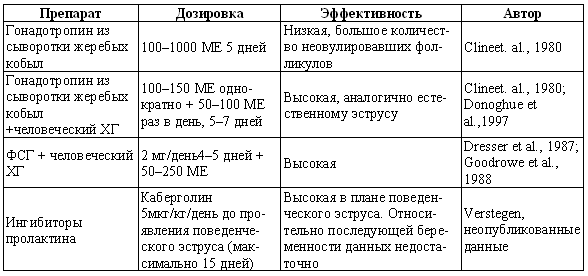 Для предотвращения наступления эструса у кошек обычно применяют мегестрола ацетат (per os 2,5 мг/животное 1 раз в неделю или 5 мг/животное 1 раз. в 2 недели) в течение нескольких месяцев. Терапию, направленную на подавление эструса, начинают не позднее 1–3 дня от начала проэструса. Опыт показывает, что при более позднем начале терапии может иметь место успешная вязка. Для подавления начавшегося эструса инъекционные формы прогестагенов не назначают, так как слишком позднее начало терапии не исключает вероятности беременности, а продолжительность воздействия инъекционных препаратов прогестагенов составляет более 3 месяцев, что может отдалять роды. Для подавления эструса пероральные препараты назначают по следующей схеме: 2,5 мг/животное ежедневно в течение 2 недель. Эструс возобновляется через несколько дней или недель после отмены терапии. При необходимости продолжения лечения доза составляет 2,5 мг/животное каждую неделю или 5 мг/животное раз в две недели. Индукция овуляции, нимфомания, кисты яичниковНа стадии эструса овуляцию стимулируют механическим раздражением влагалища или назначением гонадотропинов (ГнРГ 5–25 мкг/животное или человеческого ХГ 50–250 ME). Внутривенное или внутримышечное введение препаратов вызывает овуляцию и таким образом прекращает эструс. Овуляция происходит через 24–36 часов после инъекции, после чего наступает ложная беременность, продолжающаяся 30–45 дней. Необходимо исключить вероятность вязки в течение нескольких дней после инъекции. Нимфомания представляет собой комплексный синдром, связанный с отсутствием интервала между фолликулярными волнами (синдром распространен у сиамских кошек), либо обусловленный наличием овариальных кист (у старых животных или после индукции эструса и суперовуляции) или центральными (гипофизарными или гипоталамическими) нарушениями. Индукция овуляции с применением ГнРГ или человеческого ХГ может временно блокировать симптомы, если они связаны с кистозным поражением яичников. Нимфомания центрального происхождения — редко встречающееся состояние, иногда отмечаемое у стерилизованных животных (особенно у сиамских кошек) и характеризующееся длительным сохранением поведенческого эструса. Истинная причина подобногосостояния неизвестна, однако можно предположить связь с опухолями гипофиза. При нимфомании центрального происхождения целесообразно назначение прогестагенов. Индукция абортаКошкам индуцируют аборт гораздо реже, чем собакам, однако при необходимости результат достигается теми же методами. Для предотвращения имплантации (до 10 дня после вязки) назначают эстрогены. Введение эстрогенов вызывает гиперемию, отек и альтерацию слизистой матки, что препятствует нормальному транспорту эмбрионов и их имплантации. У кошек побочные явления, связанные с назначением эстрогенов, развиваются значительно реже, чем у собак. Аплазия костного мозга и заболевания матки наблюдаются редко. Тем не менее применять эстрогены не рекомендуется, современные подходы к этой проблеме, в частности, использование простагландинов, обеспечивают минимальный риск развития побочных эффектов. Натуральные аналоги простагландинов вводят в дозе до 500 мкг/кг 2–3 раза в день в течение 5 дней с момента подтверждения беременности. Побочные эффекты, такие, как рвота и мышечные судороги, менее выражены, чем у собак, дозозависимы и отмечаются, как правило, только в начале лечения. Относительно изолированного применения у кошек синтетических аналогов простагландинов (например, клопростенола) данных не имеется. Ингибиторы пролактина являются мощными стимуляторами аборта. Недавно было установлено, что для индукции аборта после 25 дня беременности достаточно 3 инъекций клопростенола (5 мкг/кг) с 48-часовым интервалом, если его применяют в сочетании с ежедневным пероральным приемом ингибитора пролактина каберголина (5 мкг/кг один раз в день в течение 8 дней). Аборт происходит в момент снижения концентрации прогестерона ниже критической отметки, необходимой для сохранения беременности (фиг. 17.1). Основным преимуществом такой терапии является отсутствие побочных явлений. Если аборт индуцирован до 40 дня беременности, то происходит резорбция плодов без изгнания их из полости матки. При более позднем введении препаратов происходит изгнание плодов (фиг. 17.2). В табл. 17.3 приведены сведения о различных методиках индукции аборта у кошек. 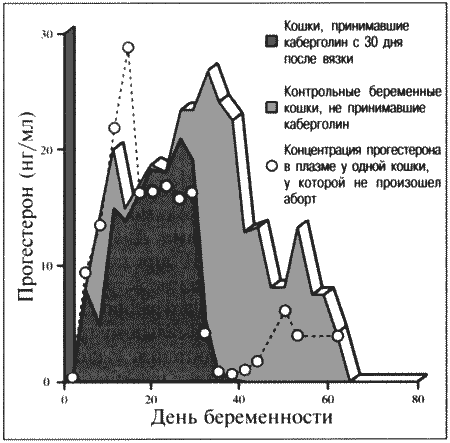 Фиг. 17.1. Фиг. 17.1. Динамика изменении концентрации прогестерона у кошек в ходе индукции аборта с назначением антипролактинов и простагландинов. Аборт происходит при снижении концентрации прогестерона в сыворотке ниже 1нг/мл (3 нмоль/л) 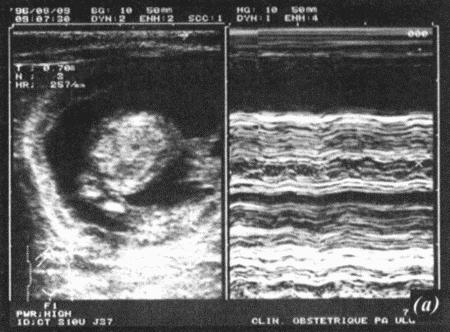 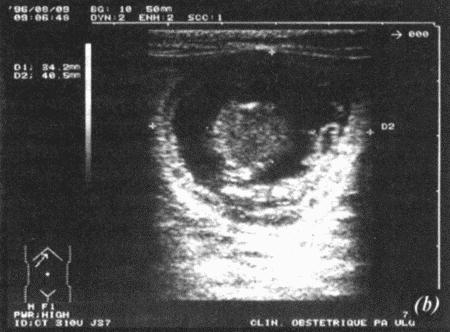 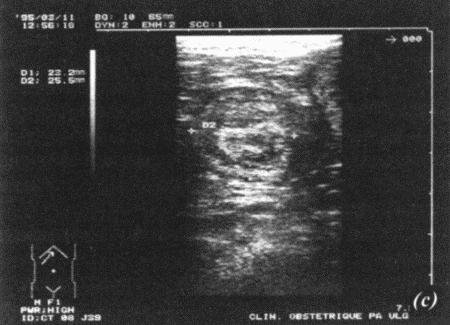 Фиг. 17.2. Фиг. 17.2. Ультрасонографическое изображение (а, b) нормальная беременность (38 дней) в результате естественной вязки; (с) резорбция эмбрионов, индуцированная каберголином в сочетании с простагландином Сохранение беременностиПредположение, что привычный аборт связан с лютеиновой недостаточностью, у кошек, как и собак, нуждается в подтверждении. Однако приблизительно на 30–45 день с начала беременности у кошек наблюдаются существенные изменения в функционировании желтых тел. Желтые тела, формирующиеся при беременности, отличаются от таковых при ложной беременности, и, вероятно, недостаточная лютеиновая поддержка может вызывать аборт. Для предотвращения аборта практикуется пероральное назначение прогестагенов (мегестрола ацетата 2,5 мг/животное через день до 55 дня беременности), однако такая терапия оправдана лишь в случае подтвержденной лютеиновой недостаточности. Назначение прогестерона в период беременности может вызывать развитие врожденных дефектов у плодов (феминизация плодов мужского пола, крипторхизм), а также задержку родов. Минимально необходимая концентрация прогестерона при беременности у кошек составляет 3 нмоль/л (1 нг/мл). Побочные явления при назначении высоких доз прогестагенов аналогичны наблюдаемым у собак. Табл. 17.3. Протоколы индукции аборта у кошек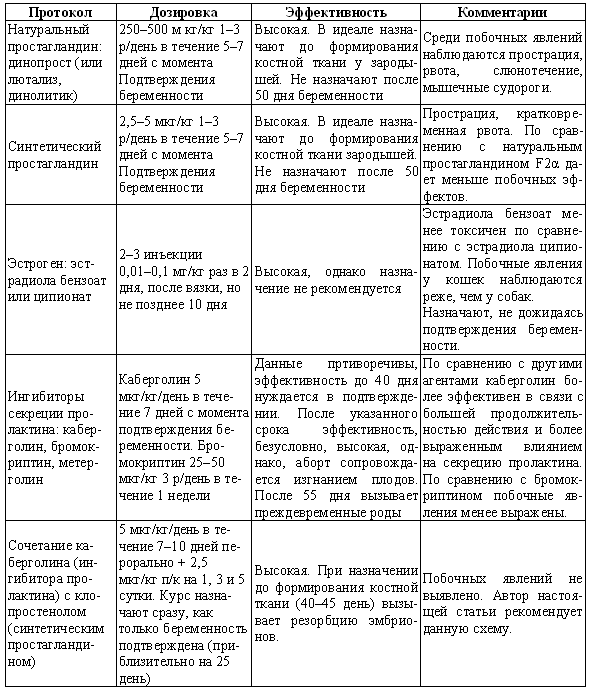 Атония матки Атония матки При первичной и вторичной атонии матки назначают окситоцин (0,5–1 МЕ/кг вводят максимум трехкратно с интервалом 20–30 мин). При вторичной атонии перед применением окситоцина выясняют причину ее возникновения. В случаях обструктивной дистоции назначение окситоцина противопоказано в связи с риском разрыва матки. Лактация: стимуляция и угнетениеСтимуляция лактации достигается назначением антагонистов дофамина (метоклопрамид 5 мг/кг в течение 3–5 дней). Препарат вводят один или два раза в день после родов и особенно после кесарева сечения. Антагонисты дофамина стимулируют выработку пролактина. Молокоотдача обеспечивается введением окситоцина после родов. Угнетение лактации вызывают использованием агонистов дофамина, подавляющих секрецию пролактина на уровне гипофиза (бромокриптина 10–25 мкг/кг или каберголина 5 мкг/кг в течение 5 дней, см. фиг. 17.3), или введением антагонистов серотонина (метерголина), стимулирующих высвобождение дофамина на уровне гипоталамуса. Прогестагены, андрогены и комбинации андрогенов-эстрогенов также посредством отрицательной обратной связи снижают секрецию пролактина и соответственно лактацию. Однако перечисленные препараты не являются специфическими и поэтому не рекомендуются особенно при доступности специфических препаратов, не вызывающих побочных явлений. Метрит/пиометра, задержка плацентыНатуральные простагландины (динопрост) применяются при пиометре для стимуляции гладкой мускулатуры матки и рассасывания желтых тел. Механизм их действия основан на способности подавлять активность, вызывать распад желтых тел и стимулировать раскрытие шейки, а также вызывать сокращения матки. Натуральные простагландины также применяются для лечения метритов и задержки плаценты, в этих случаях терапевтический эффект также объясняется способностью простагландинов вызывать сокращения матки. Простагландин вводят 3–5 раз в день в дозе 20–50 мкг/кг или 1–2 раза в день по 200–500 мкг/кг в течение 5–7 дней в сочетании с соответствующими антибиотиками и инфузионной терапией. Как правило, такая схема позволяет сохранить фертильность. Если сохранение фертильности не является непременным условием, рекомендуется овариогистерэктомия. Относительно эффективности антагонистов прогестерона RU 486 (мифепристона) или RU 46534 (аглепристона) при лечении кошек данных нет. 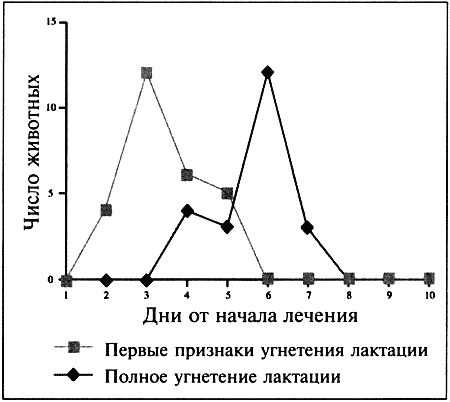 Фиг. 17.3. Фиг. 17.3. Воздействие антипролактина на послеродовую лактацию и гиперплазию молочных желез. Лечение начато на 10 день после родов При задержке плаценты назначают окситоцин, но только в том случае, если задержка диагностирована сразу после родов, поскольку чувствительность матки к окситоцину быстро снижается по окончании беременности. Послеродовое кровотечениеХороший результат обеспечивает назначение окситоцина и/или производных эрготамина (эргометрина), вызывающих сокращения матки и вазоконстрикцию. Однако в случаях геморрагии неясной этиологии такое лечение противопоказано в связи с риском разрыва матки. КОТЫ В табл. 17.4 приведены данные о заболеваниях, терапевтических препаратах и их дозировках. Разбрызгивание мочи, агрессивное поведение, возбудимостьКоты метят территорию, разбрызгивая мочу. Такое поведение характерно как для кастрированных, так и некастрированных котов и может наблюдаться при совместном содержании с другими животными, при наличии эмоциональных или социальных причин; в любом случае при содержании в квартире это недопустимо. Для интактных самцов рекомендуется кастрация, вызывающая снижение концентрации тестостерона в сыворотке крови и коррекцию соответствующих нарушений поведения, а также уменьшение характерного запаха мочи. Специфический запах, присущий самцам, объясняется присутствием тестостерона и ретроградной эякуляцией, типичной для котов. Табл. 17.4. Показания и дозировка препаратов для лечения репродуктивных проблем у котов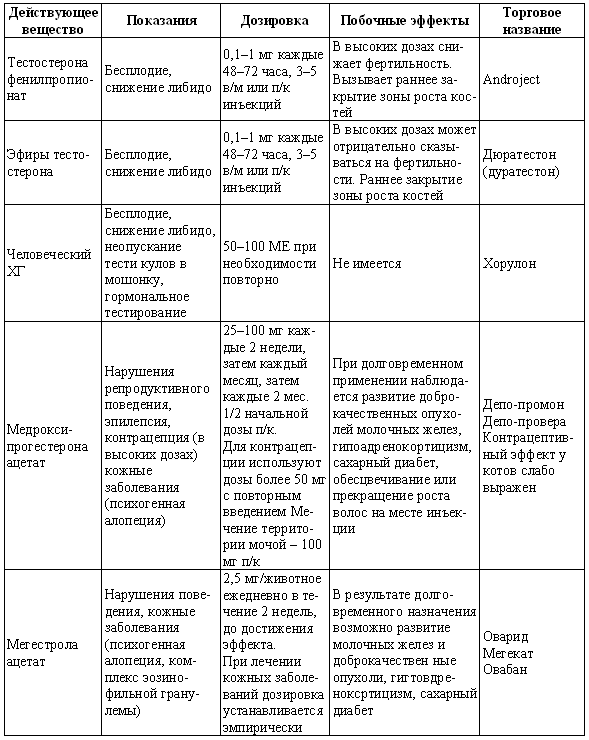 Применение прогестагенов эффективно устраняет поведенческие проблемы. Медроксипрогестерона ацетат, мегестрола ацетат, делмадинона ацетат для инъекций или пролигестон изменяют гормональный статус и оказывают центральный седативный эффект. Для достижения желаемого результата необходимо повторное введение высоких доз препаратов, однако такая схема может приводить к снижению ответной реакции. Продолжительная терапия не рекомендуется в связи с вероятностью развития побочных явлений (диабет, гипоадренокортицизм, увеличение веса). Седативные и психотропные препараты (диазепам, карбамазепин) обеспечивают временное устранение нарушений поведения. Медикаментозное лечение сочетают с поведенческой терапией. КрипторхизмЛечение, обеспечивающее опускание семенников в мошонку, у котов считают неэтичным в связи с вероятностью наследственного характера патологии. Имеются сообщения об успешном лечении крипторхизма у других видов, однако эффект от использования ГнРГ, ЛГ или тестостерона представляется сомнительным. Применение тестостерона не рекомендуется в связи с наличием общего андрогенного и анаболического эффектов. Введение тестостерона котам препубертатного возраста не только воздействует на гипоталамус по механизму отрицательной обратной связи, но оказывает анаболическое воздействие и блокирует рост костей. Билатеральная кастрация является средством первого выбора при крипторхизме. Стимуляция либидоСнижение либидо может объясняться дефектами половых желез, незрелостью или психологическими проблемами. Для лечения назначают низкие дозы тестостерона, ГнРГ или экзогенного гонадотропина (человеческого ХГ). Необходимо отметить, что вопреки распространенному мнению связь между низким уровнем тестостерона в сыворотке и снижением либидо не доказана. Ни для одной из предложенных схем не разработаны рекомендации по дозировке. Поскольку андрогены могут оказывать негативное воздействие на морфологию сперматозоидов и гипоталамус, назначение ГнРГ и человеческого ХГ с точки зрения автора является предпочтительным. Хороший результат достигается назначением 1–2 мкг ГнРГ или 50–100 ME человеческого ХГ (хорулона) или 0,1–1 мг метилтестостерона, или тестостерона пропионата каждые 48–72 часа (от 3 до 5 введений). В связи с тем, что репродуктивное поведение котов является преимущественно приобретенным, однократная стимуляция либидо может способствовать решению проблемы. Другие заболевания ЭпилепсияКак и для собак, лечение заключается в кастрации и назначении прогестагенов. Эффективность прогестагенов объясняется их седативным воздействием на ЦНС. КонтрацепцияПрепараты из группы ГнРГ (аналоги и антагонисты) назначают для угнетения выработки ФСГ и ЛГ. Блокаторы непосредственно воздействуют на рецепторы, тогда как стимуляторы вызывают снижение чувствительности после первоначальной стимуляции. И те, и другие угнетают сперматогенез и продукцию андрогенов. Иммуностерилизация представляет собой еще один метод контроля репродуктивной активности, однако на настоящий момент эффективность этого метода сомнительна, в основном в связи с необходимостью назначения вспомогательных средств для стимуляции иммунитета. Недавно был предложен новый подход к подавлению половой активности (деструкция сперматогенеза и частичная редукция секреции андрогенов) и/или стерилизация (прекращение функционирования и развитие фиброза тестикулов) с помощью склерозирующего агента, однако результаты такой терапии не обнадеживают. Основным методом является кастрация, рекомендуемая для животных, не используемых в племенном разведении. ЛИТЕРАТУРА Allen D., Pringle J., Smith D. and Conlon P. (1993) Handbook of Veterinary Drugs, p. 678. Lippincott, Philadelphia. Chastain C., Graham С. and Nichols С. (1981) Adrenocortical suppression in cats given megestrol acetate. American Journal of Veterinary Research 42, 2029–2035. Cline E., Jennings L. and Sojka N. (1980) Breeding laboratory cats during artificially induced estrus. Laboratory Animal Science, 1003–1005. Davidson A., Feldman E. and Nelson R. (1992) Treatment of feline pyometra in cats using prostaglandines F2 alpha: 21 cases. Journal of the American Veterinary Medical Association 200, 825–832. Donoghue A., Johnston L., Munson L., Brown J. and Wildt D. (1992) Influence of gonadotropin treatment interval on follicular maturiation, in vitro fertilisation, circulating steroid concentrations and subsequent luteal function in the domestic cat. Biology of Reproduction 46, 972–980. Dresser B., Sehlhorst C., Wachs K., Keller G., Gelwicks E. and Turner J. (1987) Hormonal stimulation and embryo collection in the domestic cat. Theriogenology 28, 915–927. Feldman E. and Nelson R. (1989) Diagnosis and treatment alternatives for pyometra in dogs and cats. In: Current Veterinary Therapy X, ed. R. Kirk. W. B. Saunders, Philadelphia. Goodrowe K. L., Howard J. and Wildt D. (1988) Comparison of embryo recovery, embryo quality, oestradiol, and progesterone profiles in domestic cats at natural or induced oestrus. Journal of Reproduction and Fertility 82, 553–561. Goodrowe K. L., Howard J., Schmidt P. and Wildt D. (1989) Reproductive biology of the domestic cat with special reference to endocrinology, sperm function and rh-vitro fertilisation. Journal of Reproduction and Fertility 39, 73–90. Henik R., Olson P. and Rosychuck R. (1989) Progesterone therapy in cats. Compendium on Continuing Education for the Practising Veterinarian 7, 132–144. Johnston S. (1989) Premature gonadal failure in female dogs and cats. Journal of Reproduction and Fertility 39, 65–72. Lein D. (1989) Male reproduction. In: The Cat: Disease and Clinical Management, ed. R. Sherding, p. 1475. Churchill Livingstone, New York. Lein D. and Concannon P. (1983) Infertility and infertility treatments and management in the queen and tomcat. In: Current Veterinary Therapy VIII, ed. R. Kirk, pp. 936–942. W. B. Saunders, Philadelphia. Schwartz S. (1994) Carbamazepine in the control of aggressive behaviour in cats. Journal of the American Animal Hospital Association 30, 515–519. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||
