|
||||
|
|
ГЛАВА 6 Физиология и эндокринология самца Д. Хьюитт (Denise Hewitt) ВВЕДЕНИЕ Знакомство с эндокринологическими и физиологическими особенностями репродуктивной функции является теоретической основой при андрологическом обследовании самцов. Базовые знания о нормальной репродуктивной функции самцов и о концентрации основных гормонов в периферической крови обеспечивают понимание закономерных изменений этих факторов в соответствии с возрастом и размерами животного, условиями внешней среды и воздействием лекарственных препаратов. Нарушения репродуктивной функции оценивают по отклонению данных характеристик от нормы. Физиология и эндокринология самца хорошо описаны в учебниках, однако важно иметь представление о встречающихся видовых вариациях. Специфические характеристики органов и функций репродуктивной системы кобелей хорошо изучены, чего нельзя сказать о котах. Репродуктивная система самца характеризуется тремя физиологическими функциями: продукцией и созреванием сперматозоидов в тестикулах; созреванием, накоплением и транспортом сперматозоидов в системе протоков; передачей сперматозоидов в половой тракт самки через пенис. Эндокринная регуляция также имеет три аспекта: контроль над продукцией сперматозоидов; развитие свойственных самцу физических параметров; поддержание характерного для самцов поведения (либидо и агрессия). АНАТОМИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ САМЦА Первичным органом репродуктивной системы самца являются тестикулы, производящие мужские гаметы (сперматозоиды) и стероидные гормоны (андрогены и эстрадиол). В тестикулах в отличие от женских первичных органов (яичников) к моменту рождения наличествуют не все потенциальные гаметы. Герминативные клетки подвергаются постоянному делению, формируя новые поколения сперматозоидов в ходе всей репродуктивной жизни самца. Развитие тестикулов сходно у всех видов животных. У зародышей первичные герминативные клетки располагаются в области почек. На этой стадии отличить тестикулы от яичников невозможно. Идентификация тестикулов возможна после завершения развития придатка семенника и дифференцировки протоков. В каудальном конце тестикул развивается губернакулум, смещающий тестикулы в паховый канал по мере разрастания. Достигнув этой стадии, губернакулум дегенерирует, и тестикулы сдвигаются в полость мошонки, замещая губернакулум. У большинства домашних животных опускание тестикулов завершается еще до рождения. Тестикулы опускаются в выпячивание брюшины, формирующей влагалищную оболочку внутри мошонки. У кобелей мошонка подвешена, и тестикулы располагаются практически горизонтально, тогда как у котов они расположены вплотную к телу. Величина тестикулов у собак варьирует соответственно размерам животного, однако в среднем составляет 3 х 2 х 1,5 см, коррелируя с массой тела. Тестикулы котов достигают 13 x 8 x 6 мм. Как у котов, так и у собак тонкий слой кожи, покрывающий мошонку, снабжен потовыми железами и лишен подкожного жира, что позволяет эффективно снижать температуру артериальной крови. Механизм терморегуляции предупреждает местное повышение температуры, оказывающее разрушительное воздействие на семяобразующий эпителий. Дополнительный температурный контроль у собак осуществляется с помощью мышцы кремастера, позволяющего подтягивать семенники к телу животного. У щенков опускание тестикулов в мошонку часто происходит до рождения, хотя имеются сообщения об опускании тестикулов в возрасте 6–8 месяцев. Сперматогонии в тестикулярных биоптатах обнаруживаются в возрасте 8 недель. Опускание тестикулов у котов также происходит до рождения, созревание клеток Лейдига наблюдается приблизительно к 5-месячному возрасту, тогда как сперматозоиды в семенных канальцах появляются к 6–7-месячному возрасту. Тестикулы состоят из двух типов ткани: семенных канальцев и интерстициальной ткани. Их соотношение значительно варьирует у разных видов животных. Семенные канальцы открываются в собирательные канальцы, именуемые семявыносящими протоками, которые в свою очередь входят в придаток семенника (эпидидимис). Придаток семенника подразделяют на головку, тело и хвост, которые у собак располагаются на дорсолатеральной поверхности семенника. Продвижение сперматозоидов по эпи-дидимису обеспечивается перистальтикой. Хвост придатка представляет собой резервуар для сперматозоидов, ожидающих эякуляции, и ведет к семявыводящему протоку, который также является резервуаром сперматозоидов. Хвост эпидидимиса достигает размера горошины и пальпируется в мошонке каудально. Семявыводящий проток проходит внутри влагалищной сумки и транспортирует сперматозоиды от тестикул к пенису. В секреции сперматозоидов участвуют и вспомогательные железы, которые у большинства видов обеспечивают достаточный объем эякулята и некоторые другие его параметры, например, соответствующий рН семенной жидкости. Набор вспомогательных желез у разных видов животных различен. У большинства домашних животных они представлены ампулой семяпровода, предстательной, везикулярной и бульбоуретральной железами. Ампула семявыводящего протока представляет собой резервуар для сперматозоидов, расположенный у выхода в уретру, у котов она отсутствует. Предстательная железа имеется у кобелей и котов. У кобелей она является единственной анатомически значимой добавочной половой железой, которая отличается значительными размерами и производит большой объем жидкой составляющей эякулята. У кобелей секрет простаты содержит лактат, холестерин и ферменты, но по сравнению с другими видами животных очень небольшой процент простых Сахаров. Вещество, которое используется в процессе метаболизма для выработки энергии, обеспечивающей подвижность сперматозоидов, неизвестно ни у собак, ни у кошек. У здоровой собаки предстательная железа располагается около краниального края таза и окружает конечный участок семяпровода, проксимальную часть уретры и шейку мочевого пузыря. Секрет предстательной железы постоянно выделяется в уретру. Предстательная железа симметрична и разделена бороздой на две равные доли. Как правило, простата составляет около 2 см в диаметре, хотя и варьирует в зависимости от размеров и веса животного. Предстательная железа у котов около 2 мм в диаметре и также разделена на две симметричные доли — правую и левую. В отличие от собак у котов предстательная железа не охватывает уретру с вентральной стороны. Наиболее важной добавочной половой железой у котов является не простата, а парная бульбоуретральная железа, расположенная кранио-латерально по отношению к основанию пениса и имеющая диаметр около 3 мм. У собак бульбоуретральные железы отсутствуют. Везикулярные железы отсутствуют как у кобелей, так и у котов. В половом члене у кобелей и котов имеется кость полового члена (os penis). Ее наличие позволяет самцу совершить интромиссию до достижения полной эрекции. У кобелей os penis имеет желоб, внутри которого проходит уретра (фиг. 6.1). Головка полового члена состоит из двух частей, дифференцируемых по наличию кавернозной ткани. Округлая луковица головки (bulbus glandis) состоит из кавернозной ткани, окружающей кость полового члена и уретру, тогда как краниальная длинная часть головки (pars longa glandis) содержит кавернозную ткань, расположенную дорсально вдоль кости полового члена и уретры (фиг. 6.1). Пенис кота отличается тем, что он направлен каудально и имеет маленькие шипики, расположенные вдоль головки полового члена, которые, вероятно, стимулируют выброс лютеинизирующего гормона у кошки во время интромиссии. Все перечисленные органы полностью развиваются к моменту достижения половой зрелости. 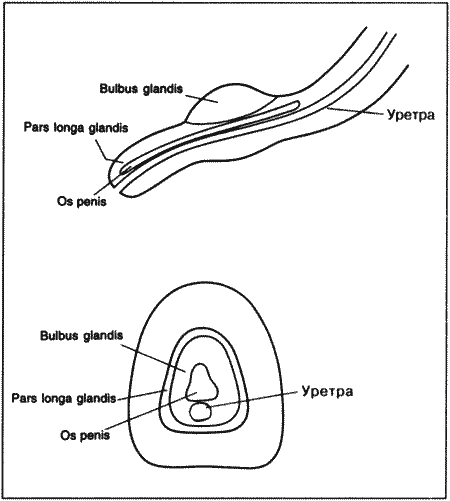 Фиг. 6.1. Фиг. 6.1. Парасагиттальное и поперечное сечение пениса кобеля, видны краниальная длинная часть головки, луковица головки, кость полового члена и уретра (Christiansen, 1954, в измененной редакции) ФИЗИОЛОГИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ САМЦА Процессы сперматогенеза (выработки сперматозоидов) и стероидогенеза (секреции гормонов) тесно взаимосвязаны, хотя и происходят в различных участках тестикулов. Это называется функциональной компартментализацией. Сперматогенез осуществляется в семенных канальцах. Они состоят из базального и адлюминального слоев, содержат клетки двух типов — герминативные (зародышевые) клетки и клетки Сертоли (соматические). В базальном слое содержатся сперматогонии, которые делятся путем митоза, ближе к просвету канальца (в адлюминальном слое) находятся сперматоциты первого порядка, проходящие стадию мейоза и трансформирующиеся в сперматоциты второго порядка, и сперматиды. Базальный и адлюминальный слои разделены клетками Сертоли, формирующими специфический гемато-тестикулярный барьер. Барьер защищает адлюминальный слой от проникновения макромолекул из крови и интерстициальной жидкости, что создает благоприятные условия для мейоза. Стероидогенез происходит в интерстициальной ткани семенников, состоящей из клеток Лейдига, тесно связанных с кровеносными и лимфатическими сосудами. Клетки Лейдига являются единственными клетками тестикулов, снабженными рецепторами ЛГ. ЛГ воздействует на рецепторы клеток Лейдига — в ответ происходит синтез некоторых стероидов, включая тестостерон. Тестостерон имеет первостепенное значение для развития вторичных половых признаков, функционирования добавочных половых желез, осуществления сперматогенеза и поддержания репродуктивной функции самца. Интерстициальные клетки окружают семенные канальцы, которые таким образом омываются жидкостью, богатой тестостероном. У кобелей процедура сбора и анализа спермы хорошо разработана, тогда как у котов она осуществляется редко и только в рамках научных исследований. В результате у котов механизм сперматогенеза изучен недостаточно, отсутствуют данные об изменениях концентраций гонадотропин-рилизинг гормонов, гонадотропинов или половых стероидов, поэтому принято считать, что взаимодействие гипоталамуса, гипофиза и тестикулов осуществляется по той же схеме, что и у собак или других домашних животных. Эндокринная регуляция репродуктивной системы самца Контроль репродуктивной функции самцов осуществляется эндокринной системой с помощью двух гонадотропинов: лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), вырабатываемых передней долей гипофиза. Секреция гонадотропинов осуществляется под влиянием гонадотропин-рилизинггормона (ГнРГ), эпизодически вырабатываемого гипоталамусом. ГнРГ возбуждает специфические рецепторы на плазматической мембране гипофизарных клеток-гонадотрофов и стимулирует выработку ЛГ и ФСГ. Выработка ГнРГ контролируется по принципу отрицательной обратной связи тестостероном и его активными метаболитами: эстрадиолом и дигидротестостероном. Механизм отрицательной обратной связи действует на уровне гипоталамуса и гипофиза, что позволяет осуществлять связь между гипоталамусом, передней долей гипофиза и семенниками (фиг. 6.2). Отрицательная обратная связь осуществляется также с помощью эстрадиола, образующегося в результате периферической ароматизации тестостерона. Секреция ЛГ и ФСГ по механизму отрицательной обратной связи является общим для обоих гонадотропинов. Этот факт необходимо иметь в виду при клиническом назначении препаратов для воздействия на репродуктивные функции (фиг. 6.3). Несмотря на наличие механизма отрицательной обратной связи, концентрация ЛГ и ФСГ не всегда повышаются одинаково, в связи с чем было высказано предположение о существовании дополнительного ингибирующего фактора, названного ингибином, который отвечает исключительно за управление секрецией ФСГ. Вероятно, другие продукты клеток Сертоли — активины — могут оказывать противоположное воздействие и стимулировать выработку ФСГ. Повышение уровня ЛГ и ФСГ после кастрации подтверждает существование отрицательной обратной связи между семенниками и гипофизом. Стимулирующий эффект ГнРГ на клетки Лейдига демонстрируется введением экзогенного ГнРГ, что приводит к повышению концентрации тестостерона в плазме крови, это можно использовать как тест для оценки функций гипофиза и клеток Лейдига. Вслед за стимуляцией посредством ГнРГ происходит немедленный, но кратковременный выброс ЛГ, концентрация которого резко нарастает, но затем быстро снижается до базальных показателей, после чего он стремительно исчезает из периферической крови. В течение 24 часов у собак бывает от 5 до 20 всплесков ЛГ. Секреция тестостерона клетками Лейдига наблюдается приблизительно через 50 минут после пика концентрации ЛГ (фиг. 6.4), причем происходит как периферическое, так и общее повышение уровня тестостерона. Периферическая циркуляция тестостерона необходима для поддержания вторичных половых признаков, сексуального поведения и отрицательной обратной связи с секрецией гонадотропинов; в то время как его периферическое действие в тестикулах обеспечивает сперматогенез. Высокая концентрация тестостерона в тестикулах постоянно поддерживается благодаря связыванию тестостерона с андроген-связывающим белком (АСБ), вырабатываемым клетками Сертоли. 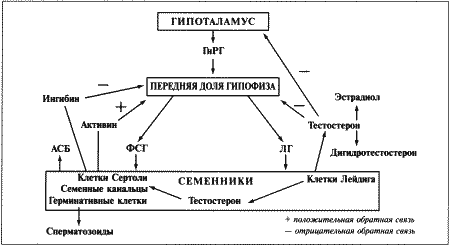 Фиг. 6.2. Фиг. 6.2. Система гипоталамус-гипофиз-семенники, отражающая влияние стероидных гормонов и гонадотропи-нов на функцию семенников. АСБ — андрогенсвязывающий белок 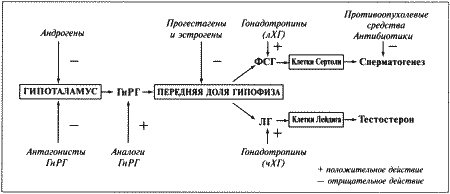 Фиг. 6.3. Фиг. 6.3. Воздействие экзогенных агентов на основные функции семенников через систему гипоталамус-гипофиз-семенники (чХГ-человеческий хорионический гонадотропин, лХГ — хорионический гонадотропин из сыворотки жеребых кобыл) ФСГ вместе с эндогенным тестостероном воздействуют на семенные канальцы, стимулируя клетки Сертоли, поддерживающие герминативные клетки. Это в свою очередь поддерживает сперматогенез, в частности развитие сперматид. Рецепторы ФСГ имеются на клетках Сертоли и, вероятно, также в сперматогониях, находящихся в семенных канальцах. Связываясь со специфическими рецепторами, ФСГ вызывает активацию аденилатциклазы, которая стимулирует выработку протеинов — АСБ и трансферрина, видимо, выполняющих важную роль в регуляции сперматогенеза, контролирует отрицательную обратную связь с помощью ингибина и, возможно, работу клеток Лейдига. Неизвестно, требуется ли ФСГ для поддержания сперматогенеза после того, как процесс уже инициирован. Механизм сперматогенеза нуждается в дальнейшем исследовании, тем более что он, вероятно, различен у разных видов животных. Известно, что у самцов одного вида цикл сперматогенеза нельзя ускорить, поэтому маловероятно, что ФСГ будет стимулировать этот процесс после того, как он начался. Вероятно, воздействие ФСГ заключается в снижении количества отмирающих герминативных клеток. По аналогии с ЛГ секреция ФСГ происходит скачкообразно, однако после стимуляции ГнРГ концентрация нарастает не так быстро, это выражается в меньшей амплитуде колебаний уровня ФСГ, наблюдаемых в периферической крови. 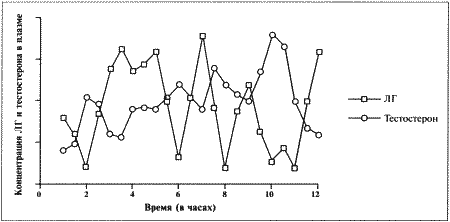 Фиг. 6.4. Фиг. 6.4. Взаимосвязь между ЛГ и секрецией тестостерона у собак Принято считать, на процесс регуляции выработки тестостерона клетками Лейдига, на которых имеются пролактиновые рецепторы, — пролактин и ЛГ влияют как синергисты. В процессе сперматогенеза на стадии продукции сперматидов происходит секреция ингибина, подавляющего секрецию ФСГ по механизму отрицательной обратной связи. Клетки Сертоли являются единственными тестикулярными клетками, связывающими ФСГ. Этот гормон косвенно стимулирует сперматогенез, воздействуя на клетки Сертоли, которые в свою очередь обеспечивают необходимую среду для развития герминативных клеток. Нормальная деятельность клеток Сертоли зависит от концентрации тестостерона, значительно более высокой в тестикулах, чем в периферической крови. Функционирование клеток Сертоли меняется в зависимости от стадии развития герминативных клеток, с которыми они связаны. Клетки Сертоли также вырабатывают вещества, контролирующие стероидогенез и сперматогенез. АСБ может обеспечивать повышение концентрации тестостерона в семенных канальцах или же осуществлять транспорт тестостерона к придатку семенника. Ингибин воздействует на переднюю долю гипофиза, вызывая угнетение секреции ФСГ, а следовательно, и сперматогенеза. Механизм действия перечисленных гормонов приведен в табл. 6.1. Концентрация гормонов у кобелей и котов Скачкообразный характер выработки ЛГ затрудняет определение его концентрации, поэтому делать анализ одной пробы не имеет смысла. Для получения объективных данных о секреции ЛГ необходима серия проб. У собак базальная концентрация ЛГ в сыворотке крови составляет 1,0–1,2 нг/мл, достигая при подъеме 3,8–10 нг/мл. Базальные показатели тестостерона составляют 1,7–5,2 ммоль/л (0,5–1,5 нг/мл), максимальные — 12,1–20,8 ммоль/л (3,5–6,0 нг/мл). Сезонные изменения отмечаются в концентрации как ЛГ, так и тестостерона, и хотя существует взаимосвязь в секреции этих двух гормонов, сезонные колебания их уровней происходят независимо. У котов концентрация ЛГ поддерживается на уровне 3–29 нг/мл. Концентрации тестостерона, секлетируемого импульсно, в течение 6 часов, варьируют от 0,3 до 11,4 ммоль/л (0,1–3,3 нг/мл). Табл. 6.1. Половые гормоны и их воздействие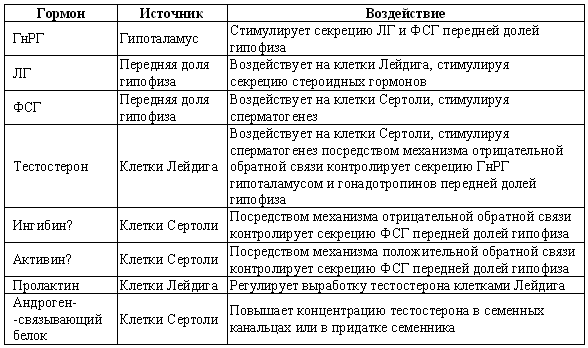 Тест с выделением экзогенного ГнРГ позволит клиницисту на основании клинических данных оценить выработку ЛГ гипофизом, а также последующий выброс тестостерона семенниками. В норме введение ГнРГ самцам вызывает повышение концентрации ЛГ в течение 30 минут, тестостерона — в течение 60 минут. СПЕРМАТОГЕНЕЗ Сперматогенез представляет собой совокупность последовательных трансформаций, в результате которых происходит образование сперматозоидов из сперматогониев при сохранении численности сперматогониев. Первичные герминативные клетки зародыша мужского пола трансформируются в гоноциты. В течение эмбрионального периода и препубертата последние проходят стадию митоза, после чего трансформируются в сперматогонии. На этом этапе развитие герминативных клеток в семенных канальцах прекращается до наступления половой зрелости. СперматоцитогенезИзначально сравнительно недифференцированные стволовые клетки сперматогониев располагаются вдоль базальной мембраны семенных канальцев и размножаются в ходе митоза. Процесс осуществляется в базальном отделе семенного канальца. Сперматоцитогенез обеспечивает циклическую выработку сперматрцитов первого порядка и поддержание численности стволовых клеток. В дополнение к названному пролиферирующему пулу существует резервный запас сперматогониев, неразмножающихся, исключительно устойчивых к радиации и токсинам, выживающих даже после тяжелой травмы тестикулов. Дальнейший процесс происходит в адлюминальном слое, где сперматоциты первого порядка, подвергаясь мейозу, трансформируются в сперматоциты второго порядка. Последние претерпевают дальнейшее мейотическое деление и преобразуются в сперматиды. СпермиогенезФинальной морфологической трансформацией является спермиогенез, заключающийся в преобразовании сферических сперматид в зрелые сперматиды, выделяющиеся в просвет семенных канальцев в виде сперматозоидов. Различные стадии сперматогенеза сопровождаются перемещением развивающихся гамет от базальной мембраны к просвету семенных канальцев. СпермиацияПроцесс продвижения герминативных клеток в просвет канальца в ходе сперматоцитогенеза и спермиогенеза называют спермиацией, а вышедшие в просвет канальца герминативные клетки уже являются сперматозоидами. Как было установлено для некоторых видов домашних животных, герминативные клетки в процессе своего развития неразрывно связаны с клетками Сертоли, подвергающимися морфологическим изменениям в соответствии со стадией развития герминативных клеток. Данных по кобелям и котам не имеется. Клетки Сертоли обеспечивают механическую поддержку и питание герминативных клеток, фагоцитоз и выработку секрета, содержащегося в просвете семенного канальца. Клетки Лейдига также принимают участие в сперматогенезе. Интерстициальные клетки окружают семенные канальцы, обеспечивая их жидкостью, богатой тестостероном. Миоидные клетки, образующие пограничную ткань семенного эпителия, способствуют продвижению сперматозоидов и жидкости в семенных канальцах. Аналогично клеткам Лейдига и Сертоли они зависят от тестикулярных факторов роста. Гистологическое исследование поперечного среза семенного канальца позволяет обнаружить различия в организации процессов (фиг. 6.5). Различия касаются типа герминативных клеток, их морфологии, стадии развития и расположения канальца. Каждый слой содержит генерацию герминативных клеток. Их дифференцировка возрастает по мере приближения к просвету канальца. В каждом участке семенного канальца наблюдается последовательное расположение различных типов клеток. Всю серию этих перемещений называют циклом сперматогенеза. Продолжительность одного сперматогенного цикла — это отрезок времени между двумя последовательными высвобождениями сперматозоидов. У кобелей он составляет 13,8 дня. В среднем продолжительность сперматогенеза у кобелей составляет 62 дня. Предполагается, что эти данные аналогичны для котов, хотя точной информации не имеется. 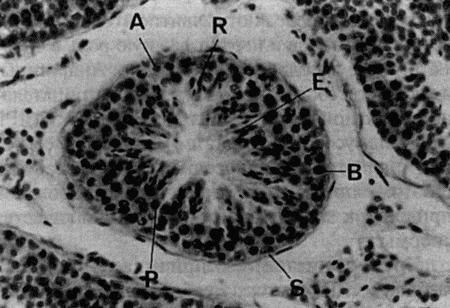 Фиг. 6.5. Фиг. 6.5. Поперечный срез семенного канальца кобеля: А-сперматогонии (А), В-сперматогоний (В), округлые сперматиды (R), продолговатые сперматиды (Е), первичные сперматоциты (Р), клетки Сертоли (S) (окрашивание нитрозин-эозином Н &Е) Последовательное перемещение поколений герминативных клеток в семенных канальцах в единицу времени называют сперматогенной волной. Такая пространственная организация обеспечивает постоянную выработку сперматозоидов, снижает потребность в гормонах и метаболитах, необходимых для данной стадии дифференцировки, устраняет вероятность застоя, связанного с одновременной спермиацией на всем протяжении канальца, а также способствует созреванию и транспорту сперматозоидов в канальце. Транспорт, созревание и накопление сперматозоидов в эпидидимисеИз семенных канальцев сперматозоиды попадают через сеть семенника и выносящие протоки в эпидидимис (в придаток семенника), где происходит финальная стадия их созревания: приобретение подвижности, трансформация мембраны и утрата цитоплазмы. Зрелые сперматозоиды накапливаются в хвостовом отделе придатка семенника. При эякуляции они проходят по семяпроводу, соединяясь с секретом придаточных желез. Важной придаточной железой является простата, а также парные бульбоуретральные железы. Дальнейшие изменения сперматозоидов, в том числе акросом, кампацитация, происходят в половом тракте самки. Процессы сперматогенеза приведены на фиг. 6.6. 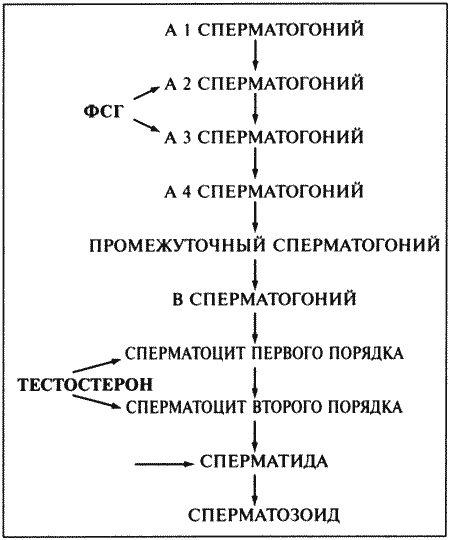 Фиг. 6.6. Фиг. 6.6. Схема сперматогенеза СПЕРМАТОЗОИДЫ С точки зрения строения сперматозоид можно разделить на головку, включающую ядро, акросому, содержащую специфические ферменты, среднюю часть, в которой расположены необходимые для метаболизма митохондрии, и хвост, обеспечивающий подвижность сперматозоида (фиг. 6.7). Сперматозоиды кобелей и котов имеют уплощенную головку, сходную с головкой сперматозоида человека, быка и кролика. Размеры сперматозоида у кобелей (приблизительно): — общая длина 68 ± 0,3 мкм; — длина головки 7 ± 0 мкм; — ширина головки 5 ± 0,1 мкм; — длина средней части 11 ±0,2 мкм; — длина хвоста 50 ± 0,3 мкм. У котов длина сперматозоида составляет около 55–65 мкм, длина головки — 6,5 мкм и ширина головки — 3 мкм. 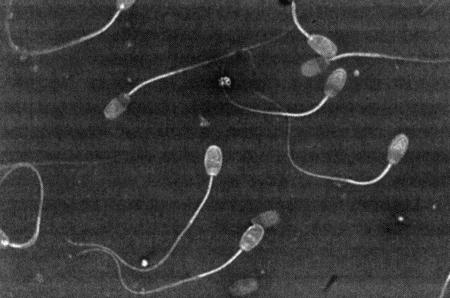 Фиг. 6.7. Фиг. 6.7. Микрофотография нормальных сперматозоидов кобеля (окрашивание нигрозин-эозином) ПРОДУКЦИЯ СПЕРМЫ Основную информацию о выработке спермы получают при исследовании эякулята. Количество сперматозоидов в эякуляте связано с частотой эякуляций, и за период полового покоя у самца в придатке семенника скапливается столько сперматозоидов, что их хватит на большое число эякулятов. Объем суточной выработки спермы можно определить только при ежедневных эякуляциях. У собак имеется хорошая корреляция между общими размерами мошонки, весом обоих семенников, весом семенниковой паренхимы, суточной продукцией спермы и количеством сперматозоидов в эякуляте. Как правило, суточная выработка спермы у собак составляет 16 х 106 на грамм семенников, то есть существенно меньше, чем у других видов, что, вероятно, объясняется длительностью сперматогенеза у собак. Как правило, эякулят крупных кобелей содержит большее количество сперматозоидов по сравнению с мелкими породами. Данных о выработке спермы у котов не имеется. Возраст самца также влияет на количество сперматозоидов. Кобели достигают половой зрелости в возрасте около 9 месяцев, т. е. несколькими неделями позже сук. Такая же картина наблюдается у кошек: самцы достигают зрелости в возрасте 8–10 месяцев, т. е. позднее самок. Негативное воздействие на продукцию спермы могут оказывать высокие и низкие температуры, радиация, некоторые лекарственные препараты, дефицит витамина А, несбалансированное питание и токсические вещества. Длительность периода воздержания влияет на количество сперматозоидов в эякуляте. Если этот период продолжительный, в системе протоков скапливаются старые сперматозоиды, которые выводятся либо со спермой, либо с мочой. ВОЗДЕЙСТВИЕ ЭКЗОГЕННЫХ АГЕНТОВ НА СТЕРОИДОГЕНЕЗ И СПЕРМАТОГЕНЕЗ Воздействие некоторых терапевтических средств на клетки Сертоли может отразиться на сперматогенезе. Лекарственные препараты влияют также на процесс созревания и накопления сперматозоидов в придатке семенника. Некоторые агенты оказывают влияние на сперматогенез, воздействуя на секрецию андрогенов (от которых зависят мейоз и развитие сперматозоидов в придатке семенника), клетки Лейдига или косвенно влияя на секрецию ЛГ. Влияние экзогенных препаратов представлено на фиг. 6.3. АндрогеныАндрогены определяют развитие вторичных половых признаков и играют важную роль в сперматогенезе и поддержании либидо. Андрогены, включая тестостерон, по механизму отрицательной обратной связи подавляют выработку ГнРГ гипоталамусом, в результате уменьшается секреция гонадотропинов передней долей гипофиза. Поэтому применение экзогенных андрогенов приводит к значительному снижению качества спермы. Предполагается, что причина сниженного либидо и импотенции у собак — в низкой концентрации эндогенного тестостерона. Однако для лечения этого состояния назначение андрогенов (тестостерона) не рекомендуется в связи с негативным воздействием на сперматогенез. Во многих случаях импотенция является результатом костно-мышечных болей или психологических проблем, и в этих случаях андрогены не являются препаратами первого выбора. ПрогестагеныПрименение прогестагенов основано на их антиандрогенном эффекте и способности подавлять секрецию гонадотропинов. Самцам прогестагены назначают в той же дозировке, которая рекомендована самкам для контроля циклической активности. Эти дозы не оказывают негативного воздействия на продукцию спермы или либидо, при повышении дозировки могут наблюдаться побочные явления, однако недостаточные для развития бесплодия. Прогестагены сами по себе не обеспечивают контрацептивного воздействия, однако в сочетании с тестостероном могут снижать качество спермы на период до 50 дней, хотя не подавляют ни либидо, ни сперматогенез. Способность прогестагенов снижать концентрацию андрогенов в крови используется для лечения некоторых патологий. Например, как кастрированные, так и интактные самцы могут демонстрировать проблемное поведение, включая агрессию, мечение территории, недопустимую садку, возбудимость и деструктивное поведение. Для контроля большинства перечисленных проблем с успехом применяют модификацию поведения (методом дрессировки), которую осуществляют на фоне приема прогестагенов. Возможно, антисоциальное или агрессивное поведение не связано с повышенной концентрацией тестостерона в периферической плазме. Снижение концентрации тестостерона в плазме крови (в результате приема прогестагенов или после кастрации) обеспечивает успешное лечение других патологий, связанных с воздействием андрогенов (доброкачественной гиперплазии предстательной железы, перианальной аденомы, некоторых эпилептических припадков). Иногда андрогены из-за их анаболического действия используются при лечении старых собак. ЭстрогеныВысокие дозы эстрогенов воздействуют на физиологию репродуктивной системы самца посредством подавления выработки гонадотропинов. Эстрогены успешно применяются для контроля некоторых поведенческих проблем у собак. Увеличение простаты, если оно вызвано гиперплазией, может быть уменьшено с помощью эстрогеновой терапии. Доброкачественные опухоли промежности, анальные аденомы поддаются лечению с помощью эстрогенов. ГонадотропиныЧеловеческий хорионический гонадотропин (чХГ) по своему воздействию сходен с ЛГ и вызывает повышение секреции тестостерона клетками Лейдига. Хорионический гонадотропин, получаемый из сыворотки крови жеребых кобыл (лХГ), действует подобно ФСГ и стимулирует сперматогенез в семенных канальцах. Однако действие этих препаратов нефизиологично и обеспечивает лишь кратковременный эффект, в связи с чем человеческий ХГ и лошадиный ХГ не применяются для лечения гипоплазии тестикул или крипторхизма. Тем не менее тест с использованием человеческого ХГ применяют, чтобы установить присутствие тестикулярной ткани. Аналоги ГнРГАналоги ГнРГ стимулируют секрецию гонадотропинов гипофизом, однако эффект их воздействия нефизиологичен, а продолжительная стимуляция приводит к снижению чувствительности рецепторов. Названные препараты используют как контрацептивы в связи с их способностью вызывать прекращение эякуляции и снижение количества подвижных сперматозоидов в результате 3-недельного лечения. После отмены терапии нормальная продукция спермы быстро восстанавливается. Антагонисты ГнРГАнтагонисты ГнРГ блокируют его активность и, возможно, будут использоваться в качестве контрацептивных агентов в будущем. Другие агентыПри выборе препарата для лечения самцов следует проявлять осторожность, поскольку многие препараты могут оказывать нежелательное воздействие на репродуктивную функцию. К таким агентам относятся: • противоопухолевые препараты, вызывающие аплазию герминативного эпителия тести кул; • антибиотики нитрофурантоин и амфотерицин, угнетающие сперматогенез; • гризеофульвин, в высоких дозах вызывающий олигоспермию. ЗАКЛЮЧЕНИЕ Сведения, приведенные в настоящей главе, способствуют углублению знаний об особенностях репродуктивной функции самца, что позволяет облегчить диагностику патологий репродуктивной системы и выбор соответствующего лечения. ЛИТЕРАТУРА Ettinger S. (1995) Textbook of Veterinary Internal Medicine, 4th edn.W. B. Saunders, Philadelphia. Ogilvie G. and Moore A. S. (1995) Managing the Veterinary Cancer Patient. Veterinary Learning Systems, Trenton, New Jersey. Owen L. N. (1980) TNM Classification of Tumours in Domestic Animals.WHO, Geneva. Slater D. H. (1985) Textbook of Small Animal Surgery. W. B. Saunders, Philadelphia. Theilen G. H. and Madewell B. R. (1987) Veterinary Cancer Medicine. Lea & Febiger, Philadelphia. White R. A. S. (1991) Manual of Small Animal Oncology. BSAVA, Cheltenham. Burke T. J. (1986) Small Animal Reproduction and Infertility, A Clinical Diagnosis and Treatment. Lea and Febiger, Philadelphia. Christiansen G. C. (1954) Angioarchitecture of the canine penis and the process of erection. American Journal of Anatomy 95, 227–262. Christiansen I. B. J. (1984) Reproduction in the Dog and Cat. Bailliere Tindall, London Depalatais L., Moore J. and Falvo R. E. (1978) Plasma concentrations of testosterone and L. H. in the male dog. Journal of Reproduction and Fertility 52, 201–207. Feldman E. C. and Nelson R. W. (1996) Canine male reproduction. Clinical and diagnostic evaluation of the male reproductive tract. In: Canine and Feline Endocrinology and Reproduction, 2nd edn, pp. 673–690. W. B. Saunders, Philadelphia. Foote R. H., Swierstra Е. Е. and Hunt W. L. (1972) Spermatogenesis in the dog. Anatomical Record 173, 341–351. Schmidt P. M. (1986) Feline breeding management. Veterinary Clinics of North America: Small Animal Practice 16, 435–451. Soderberg S. F. (1986) Canine breeding management. Veterinary ClinicsofNorth America: Small Animal Practice16, 16, 419–433. Wxidall P. F. and Johnstone I. P. (1988) Dimensions and allometry of testes, epididymes and spermatozoa in the domestic dog (Cam's familiaris). Journal of Reproduction and Fertility 82, 603–609. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||
