|
||||
|
|
ЛЕКЦИЯ № 5. Сплавы 1. Строение металлов Металлы и их сплавы – основной материал в машиностроении. Они обладают многими ценными свойствами, обусловленными в основном их внутренним строением. Мягкий и пластичный металл или сплав можно сделать твердым, хрупким, и наоборот. Для того чтобы сознательно изменять свойства металлов, необходимо знать основы их кристаллического строения. Как известно, все тела состоят из большого количества атомов, которые удерживаются силами сцепления, совершая колебания большой частоты возле точек равновесия. Поскольку атомы разных металлов различны, каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от расстояния между ними. Если изменить расстояние между атомами или порядок их расположения, изменятся и свойства металла. В аморфных телах – смоле, стекле, канифоли и т. п. – атомы расположены беспорядочно. В металлах они находятся в определенном геометрическом порядке, образуя кристаллы, поэтому металлы являются кристаллическими телами. Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой, которая представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы. Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно—центрированную, кубическую гранецентрированную и гексагональную. В ячейке кубической объемно—центрированной решетки атомы расположены в вершинах и центре куба. Такая ячейка содержит девять атомов (хром, вольфрам, ванадий, молибден, литий, а при определенных температурах – железо и другие металлы). В ячейке кубической гранецентрированной решетки атомы находятся в вершинах куба и на пересечении диагоналей каждой плоскости. Такая ячейка имеет 14 атомов (свинец, никель, медь, золото, серебро, пластина, железо при определенных температурах и другие металлы). В ячейке гексагональной кристаллической решетки атомы располагаются в вершинах и в центре шестигранных оснований призмы, а три атома – в средней ее плоскости, при этом такая ячейка содержит 17 атомов (магний, цинк, кадмий, осмий, бериллий и другие металлы). При определенных условиях некоторые металлы – железо, титан, цирконий, стронций, кобальт, кальций и другие могут перестраиваться из одного вида кристаллической решетки в другой, например из кубической объемно—центрированной – в гранецентрированную и даже гексагональную. Элементарная ячейка отображает только один элемент, или одну ячейку, кристаллической решетки. Вся кристаллическая решетка в реальном металле состоит из большого числа многократно повторяющихся элементарных ячеек. Большое значение имеет расстояние между атомами ячейки кристаллической решетки или между параллельными атомными плоскостями, образующими элементарную ячейку. Чем больше это расстояние, тем менее прочен металл. Расстояние между ними измеряется в ангстремах – 1 А = = 10 –8 см или в нанометрах – 1 А = 0,1 нм. Из практики известно, что железо прочнее меди, а медь прочнее алюминия. 2. Кристаллизация и структура металлов и сплавов Порядок расположения атомов – тип кристаллической решетки – природное свойство металла, форма кристаллов и их размеры зависят от процесса перехода металла из жидкого состояния в твердое. Процесс образования кристаллов при затвердевании металлов называется кристаллизацией. При кристаллизации металлов выделяется тепло, а при переходе металлов из твердого состояния в жидкое происходит поглощение тепла. Наблюдения с помощью измеряющих температуру проборов за процессом понижения температуры при переходе металла из жидкого состояния в твердое позволили установить определенную закономерность. Сначала температура понижается равномерно. В начальный период образования кристаллов вследствие выделения скрытой теплоты при формировании кристаллической решетки падение температуры прекращается, и она остается неизменной до полного затвердения металла. После того как весь металл затвердеет, температура снова начинает понижаться. Температура, соответствующая горизонтальной площадке, называется критической. Кристаллизация металлов подобна кристаллизации солей, и этот процесс состоит из двух элементарных процессов, протекающих одновременно. Первый заключается в образовании центров кристаллизации, или зародышей кристаллов, второй – в росте кристаллов из этих центров. Первый этап – появление зародышей кристаллов металла. Второй этап – по мере остывания металла к зародышам присоединяются все новые и новые атомы жидкого металла, которые группируются в определенном порядке один возле другого, образуя элементарные ячейки кристаллической решетки. Этот процесс продолжается до тех пор, пока не закончится кристаллизация. Причем кристаллы затвердевшего металла имеют неправильную и весьма разнообразную форму, что объясняется условиями кристаллизации. В процессе кристаллизации увеличивается количество кристаллов – в 1 мм 3 может образоваться свыше 1000 кристаллов. Кристаллы, имеющие неправильную внешнюю форму, называются кристаллитами, или зернами. Чистые металлы относительно редко применяются в машиностроении и других отраслях хозяйственного комплекса. Более широко используются сплавы, состоящие из двух и более элементов (из двух металлов, например меди и цинка, или из металла и неметалла, например железа и углерода). Элементы, входящие в сплав, называются компонентами. В зависимости от расположения атомов в кристаллической решетке различают твердые растворы замещения и твердые растворы внедрения. В твердом растворе замещения атомы растворимого компонента замещаются атомами растворителя, а в твердом растворе внедрения атомы растворителя размещаются между атомами растворимого компонента в наиболее слабых местах элементов кристаллической решетки. Сплавы, представляющие собой твердые растворы, отличаются ценными свойствами. Они тверже и прочнее, чем входящие в него компоненты. Компоненты некоторых сплавов при кристаллизации могут входить в химическую связь, образуя химическое соединение. Химические соединения обладают очень высокой твердостью и хорошим электросопротивлением. 3. Диффузионные и бездиффузионные превращения Под диффузией понимают перемещение атомов в кристаллическом теле на расстояния, превышающие средние межатомные расстояния данного металла. Если перемещения атомов не связаны с изменением концентрации в отдельных объемах, то такой процесс называется самодиффузией. Диффузия, сопровождающаяся изменением концентрации, называется гетеродиффузией. В тех случаях, когда гетеродиффу—зия сопровождается образованием новых фаз, что наиболее часто имеет место при химико—технической обработке, она называется реактивной диффузией. В основе процесса диффузии лежит атомный механизм, при котором каждый атом совершает более или менее случайные блуждания. Диффузионные превращения в металлах происходят при различных химико—термических обработках – хромировании, цементации, алютировании (алюминирование) и т. д. Хромирование обеспечивает повышенную жаростойкость стали до 800 °C, высокую коррозионную стойкость в таких средах, как пресная и морская вода, уксусная и фосфорная кислоты, и эрозионную стойкость при низкой и высокой температурах. Хромирование сталей, содержащих более 0,3–0,4 % углерода, повышает также твердость и износостойкость. При хромировании диффузионный слой состоит из раствора хрома в? – железе, а содержание хрома на поверхности составляет 25–50 %. При этом процессе в случае применения CrCl 2 протекает следующая реакция: CrCl 2 + Fe > FeCl 2 + Cr. При термической обработке стали наблюдаются бездиффузные, или аллотропические, превращения в процессе вторичной кристаллизации. В частности, при температуре +775 °C в стали, содержащей 0,6 % углерода, начинаются аллотропические превращения, т. е. выделение феррита из аустенита (твердого раствора углерода (до 2,14 %)) и других примесей в объеме железа. Феррит – твердый раствор небольшого количества углерода (до 0,04 %) и других примесей в? – железе – мягкая, пластичная и недостаточно прочная структурная составляющая. Так как в феррите содержится ничтожное количество углерода, оставшийся аустенит будет постепенно, по мере выделения феррита, обогащаться углеродом. Когда концентрация углерода в оставшемся аустените достигнет 0,8 %, при температуре +727 °C сталь, содержащая 0,6 % углерода, будет иметь в своем составе феррит и аустенит, а при температурах ниже +727 °C – феррит и перлит, причем структура феррит – перлит сохранится без значительных изменений и при дальнейшем охлаждении стали вплоть до комнатной температуры. Аналогичные превращения характерны для всех доэвтек—тоидных сталей (содержащих менее 0,8 % углерода). Разница будет лишь в температурах начала выделения феррита. Причем, если сталь содержит 0,8 % углерода, ее вторичная кристаллизация будет протекать при постоянной температуре (+727 °C) и сопровождаться только одним процессом – образованием перлита. Это объясняется тем, что в данном случае содержание углерода в стали соответствует эвтектоидному составу – механической смеси кристаллов, выделяющихся из жидкого сплава одновременно. При этом создается мелкозернистая структура сплава. 4. Классификация сплавов. Железо и его сплавы Сталь и чугун – основные материалы в машиностроении. Они составляют 95 % всех используемых в технике сплавов. Сталь – это сплав железа с углеродом и другими элементами, содержащий до 2,14 % углерода. Углерод – важнейшая примесь стали. От его содержания зависят прочность, твердость и пластичность стали. Кроме железа и углерода, в состав стали входят кремний, марганец, сера и фосфор. Эти примеси попадают в сталь в процессе выплавки и являются ее неизбежными спутниками. Чугун – сплав на железной основе. Отличие чугуна от стали заключается в более высоком содержании в нем углерода – более 2,14 %. Наибольшее распространение получили чугуны, содержащие 3–3,5 % углерода. В состав чугунов входят те же примеси, что и в стали, т. е. кремний, марганец, сера и фосфор. Чугуны, у которых весь углерод находится в химическом соединении с железом, называют белыми (по виду излома), а чугуны, весь углерод которых или большая его часть представляет графит, получили название серых. В белых чугунах всегда имеется еще одна структурная составляющая – ледебурит. Это эвтектика, т. е. равномерная механическая смесь зерен аустенита и цементита, получающаяся в процессе кристаллизации, в ней 4,3 % углерода. Ледебурит образуется при температуре +1147 °C. Феррит – твердый раствор небольшого количества углерода (до 0,04 %) и других примесей в? – железе. Практически это чистое железо. Цементит – химическое соединение железа с углеродом – карбид железа. Перлит – равномерная механическая смесь в сплаве феррита и цементита. Такое название эта смесь получила потому, что шлиф при ее травлении имеет перламутровый оттенок. Так как перлит образуется в результате процессов вторичной кристаллизации, его называют эвтектоидом. Он образуется при температуре +727 °C. В нем содержится 0,8 % углерода. Перлит имеет две разновидности. Если цементит в нем расположен в виде пластинок, его называют пластинчатым, если же цементит расположен в виде зерен, перлит называют зернистым. Под микроскопом пластинки цементита кажутся блестящими, потому что обладают большой твердостью, хорошо полируются и при травлении кислотами разъедаются меньше, чем пластинки мягкого феррита. Если железоуглеродистые сплавы нагреть до определенных температур, произойдет аллотропическое превращение ? —железа в ? —железо и образуется структурная составляющая, которая называется аустенитом. Аустенит представляет собой твердый раствор углерода (до 2,14 %) и других примесей в ? —железе. Способность углерода растворяться в железе неодинакова при различных температурах. При температуре +727 °C ? —железо может растворять не более 0,8 % углерода. При этой же температуре происходит распад аустенита с образованием перлита. Аустенит – мягкая структурная составляющая. Он отличается большой пластичностью, не обладает магнитными свойствами. При изучении структурных составляющих железоуглеродистых сплавов установлено, что они при комнатной температуре всегда состоят из двух структурных элементов: мягкого пластичного феррита и твердого цементита, упрочняющего сплав. 5. Диаграммы состояния сплавов Сплавы можно получать при соединении большинства металлов друг с другом, а также с неметаллами. Диаграммы состояния сплавов дают наглядное представление о протекающих в сплавах превращениях в зависимости от их химического состава и температуры. При построении диаграмм состояния сплавов на оси абсцисс указывают химический состав или концентрацию сплава в процентах. Для этого горизонтальную линию определенной длины делят на сто одинаковых частей и каждое деление принимают за 1 % одного из компонентов сплава. 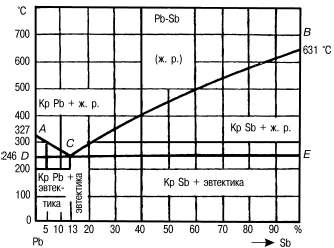 Рис. 5. Диаграмма состояния сплавов системы свинец—сурьма (Pb—Sb) Точка А соответствует чистому свинцу, а точка В – чистой сурьме. По оси ординат в определенном масштабе указывают температуру. Для того чтобы построить диаграмму состояния сплавов, сначала строят ряд кривых охлаждения сплавов одних и тех же элементов с различной концентрацией. На основе этих кривых строят диаграмму. Сплавы, компоненты которых при затвердевании образуют только механические смеси, относятся к первой группе. Диаграмма этих сплавов условно называется диаграммой состояния первого рода. Диаграмма сплавов, образующих при затвердевании только твердые растворы, называется диаграммой состояния второго рода. Наиболее типичными для диаграмм первого рода являются сплавы свинца с сурьмой. Построение диаграммы (первого рода) состояния сплавов Pb—Sb: 1) кривые охлаждения доэвтектических сплавов; 2) диаграмма состояния сплавов Pb—Sb; 3) кривые охлаждения заэвтектических сплавов. Диаграмма построена для пяти видов сплава свинца с сурьмой: 1) 5 % сурьмы и 95 % свинца; 2) 10 % сурьмы и 90 % свинца; 3) 20 % сурьмы и 80 % свинца; 4) 40 % сурьмы и 60 % свинца; 5) 80 % сурьмы и 20 % свинца. Все они имеют две критические температуры: верхнюю и нижнюю. Изучение процессов кристаллизации этих сплавов показывает, что верхняя критическая температура соответствует началу, а нижняя – концу затвердевания сплава. Таким образом, процесс кристаллизации сплавов Pb—Sb резко отличается от кристаллизации чистых металлов. Сплавы кристаллизуются в интервале температур, а чистые металлы – при постоянной температуре. Механическая смесь кристаллов, выделяющихся из жидкого сплава одновременно, называется эвтектикой (в переводе с греческого – «хорошо сложенный»). Сплавы указанной концентрации называют эвтектическими. Линия АСВ на диаграмме называется линией ликвидуса (в переводе с греческого – «жидкий»). Выше этой линии любой сплав свинца с сурьмой находится в жидком состоянии. Линия ДСВЕ получила название линии солидуса (в переводе с греческого – «твердый»), или эвтектической линии. Точка С показывает состав эвтектики. Сплавы, расположенные левее этой точки, называют доэвтектическими, правее ее – заэвтектическими. В структуре доэвтектических сплавов, кроме эвтектики, всегда есть некоторое количество свинца, а в заэвтектических, кроме эвтектики, – сурьмы. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Другие сайты | Наверх |
||||
|
|
||||
